En 1786, l'anatomiste italien Luigi Galvani (1737-1798) disséqua une grenouille sur sa table, sur laquelle se trouvait une machine électrostatique. Galvani a vu les muscles de l'animal se contracter lorsque son assistant a accidentellement touché le bout de son scalpel avec le nerf interne de la cuisse de la grenouille. En d'autres termes, cela s'est produit lorsque les tissus de la grenouille ont été touchés par deux métaux différents.
Galvani a commencé à défendre, à partir de ce moment, une théorie qui tentait d'expliquer ce fait: la théorie de « l'électricité animale ». Selon Galvani, les métaux n'étaient que des conducteurs d'électricité, qui en réalité seraient contenus dans les muscles de la grenouille.
Cependant, sa théorie était fausse et cela a été vu par le physicien italien Alessandro Volta (1745-1827), qui a effectué plusieurs expériences et remarqué que lorsque la plaque et le fil étaient faits du même métal, les convulsions n'apparaissaient pas, montrant qu'il n'y avait pas d'écoulement de électricité. Ainsi, il a poursuivi en défendant le concept (correct) selon lequel l'électricité ne provenait pas des muscles de la grenouille, mais des métaux et que les tissus de l'animal conduisaient cette électricité.
Pour prouver qu'il avait raison, Volta a fait un circuit formé par une solution électrolytique, c'est-à-dire une solution avec des ions dissous, qu'il appela conducteur humide ou conducteur de seconde classe, mis en contact avec deux électrodes métallique. Ces derniers, Alessandro Volta appelaient conducteurs secs ou conducteurs de première classe.
Il l'a fait en plaçant un conducteur humide (qui était une solution saline aqueuse) entre deux conducteurs secs (qui étaient des métaux reliés par un fil conducteur). A ce moment, il a observé que le flux électrique s'éveillait. Il a également compris que selon les métaux qu'il utilisait, le flux de courant pouvait être plus ou moins grand. Ainsi, on peut admettre que l'idée de ce qu'est une pile était déjà comprise et expliquée par Volta.
En 1800, Volta créa la première pile électrique, qui fut appelée la pile arrière, pile galvanique ou alors cellule voltaïque et encore, "chapelet". Un schéma de cette pile est montré ci-dessous: il a placé un disque de cuivre au-dessus d'un disque de feutre trempé dans une solution d'acide sulfurique, et enfin un disque de zinc; et ainsi de suite, en empilant ces séries dans une grande colonne. Le cuivre, le feutre et le zinc avaient un trou au milieu et étaient enfilés dans une tige horizontale, étant ainsi reliés par un fil conducteur.
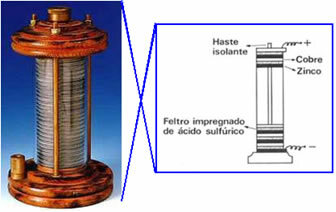
Cette expérience a provoqué des bouleversements dans le monde scientifique et dès lors tous les appareils qui produisaient de l'électricité à partir de procédés les produits chimiques (c'est-à-dire qui ont produit de l'énergie chimique en énergie électrique) ont été appelés cellules voltaïques, cellules galvaniques ou, simplement, des piles.
Volta a fait la même expérience avec différents métaux et solutions électrolytiques, tels que des disques d'argent et de zinc séparés par des disques de flanelle imbibés de saumure. Il a même effectué une démonstration de cette découverte pour Napoléon Bonaparte, comme le montre la figure ci-dessous, à l'Académie des sciences de Paris.

Alessandro Volta démontre sa découverte à Napoléon
Une autre expérience de Volta avec les batteries était la couronne de verres, dans lequel il plaça deux plaques de métaux différents reliées entre elles par un fil conducteur, mais séparées par des solutions électrolytiques.
Nous savons actuellement que ce qui se passe dans une cellule, comme celles créées par Volta, c'est que l'électricité s'écoule du pôle. négatif, appelé anode, qui s'oxyde, perdant des électrons au pôle positif, appelé cathode, qui se réduit, gagnant électrons.
Ces batteries fabriquées en solution aqueuse sont peu utilisées de nos jours; juste en termes de recherche, mais ils étaient le principe qui a développé les batteries modernes que nous connaissons aujourd'hui sous le nom de batteries sec et qui sont beaucoup plus pratiques à utiliser et à transporter, tout en fournissant un courant électrique satisfaisant pour beaucoup plus. temps.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/historia-das-pilhas.htm
