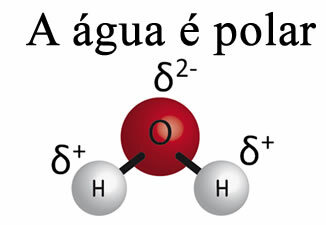
L'eau seule ne peut pas enlever la graisse des matériaux. Ceci est dû au fait lel'eau est polaire, comme le montre l'image ci-dessous, en raison de la différence d'électronégativité qui existe entre les atomes d'hydrogène et d'oxygène de leurs molécules. D'autre part, la graisse est non polaire et donc l'eau ne dissout pas les graisses.
De plus, l'eau a ce qu'on appelle tension superficielle. Vous pouvez mieux comprendre cela dans le texte. Tension superficielle de l'eau, mais fondamentalement, c'est une sorte de film ou de membrane élastique qui se forme à la surface de l'eau, ce qui l'empêche de pénétrer dans les tissus et autres matériaux pour enlever la saleté. Les molécules d'eau s'attirent dans toutes les directions à travers liaisons hydrogène, mais les molécules de surface n'interagissent qu'avec les molécules sur le côté et en dessous, créant une différence de forces de cohésion, ce qui provoque la contraction des molécules de surface et la formation de cette tension de surface.
C'est là qu'interviennent les savons et les détergents (du latin désintoxiquer = clair), qui sont aussi appelés agents tensioactifs, car ils ont la capacité de réduire la tension superficielle de l'eau et, en outre, d'interagir avec l'eau et la graisse. Comment cela peut-il arriver?
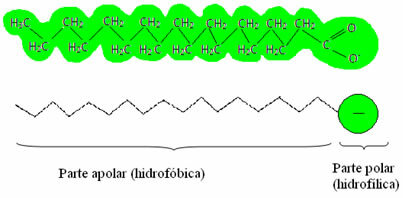
Les savons et les détergents contiennent des sels d'acides gras, qui sont de longues molécules formées par un partie non polaire (Qu'est-ce que hydrophobe – hydraulique = eau ; phobique = aversion) et une extrémité polaire (hydrophile – hydraulique = eau ; phylum = ami). Ci-dessous, nous avons une structure typique d'un savon :
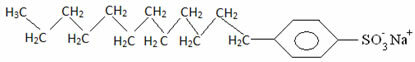
Généralement, les détergents sont des sels d'acides sulfoniques à longue chaîne :
Ainsi, la partie non polaire de ces molécules présentes dans les savons et les détergents interagit avec la graisse, tandis que l'extrémité polaire interagit avec l'eau, se regroupant en petits globules, appelé de micelles, dans laquelle les parties hydrophiles font face à l'extérieur de la micelle en contact avec les molécules d'eau, et le la graisse reste à l'intérieur, en contact avec la partie non polaire ou hydrophobe, un processus similaire à celui montré dans l'image a poursuivre:
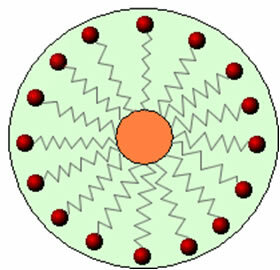
De cette façon, la saleté grasse est piégée au centre des micelles et peut être éliminée. Un autre point est que les détergents et les savons ont la capacité d'abaisser la tension superficielle de l'eau, car diminuer les interactions entre ses molécules, lui permettant ainsi de pénétrer plus facilement divers matériaux pour éliminer les saleté.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm

