LES stéréoisomérie, aussi connu sous le nom Isomérie spatiale, est un type d'isomérie dans lequel ses isomères sont différenciés par les liaisons entre leurs atomes étant disposées différemment dans l'espace.
Il existe deux types de stéréoisomères, les diastéréoisomères et le énantiomères. Les diastéréoisomères sont des isomères géométriques de type cis-trans, qui ne sont pas des images miroir les uns des autres, tandis que les énantiomères sont des isomères optiques qui sont des images miroir les uns des autres.
Parler un peu de la diastéréoisomère cis-trans, il ne se produit que dans les composés insaturés ou cycliques. Pourquoi ne se produit-il pas dans les composés à chaîne saturée, c'est-à-dire qui n'ont que des liaisons simples entre les carbones ?
Il peut arriver que l'on se confond en pensant que certains composés saturés sont des diastéréoisomères, alors qu'en fait ils représentent le même composé. Par exemple, ci-dessous, nous avons trois conformations spatiales des atomes de 1,2-dichloroéthane :
H H H H H Cl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Cl ClCl H Cl H
S'agit-il de trois diastéréoisomères? Ne pas. En fait, les trois molécules sont du même composé. Ce qui se passe, c'est que les liaisons simples ou sigma (σ) entre les carbones peuvent subir des rotations, entraînant des arrangements atomiques différents.
Voyez comment cela se produit dans le schéma ci-dessous avec l'éthane :

Ces composés, qui sont en fait le même composé, n'effectuent pas d'isomérie cis-trans géométrique, mais sont appelés isomères conformationnels, car ils ne diffèrent que par la conformation de leurs atomes causée par la rotation autour de la liaison simple.
L'une des façons de représenter ces molécules pour faciliter la visualisation de la rotation de l'axe de connexion est à travers le La projection de Newman, dans lequel il est considéré comme si le plan de vision était exactement sur l'axe de la liaison entre les carbones et ils sont représentés par un cercle central. Voir la projection de Newman pour l'éthane :

On peut aussi représenter ces différentes conformations à travers les formule sur chevalets :
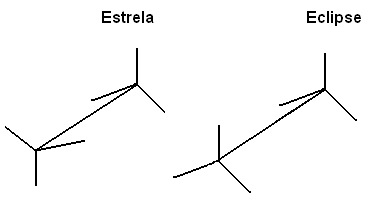
Cette libre rotation de l'axe de liaison ne se produit plus dans les composés insaturés ou dans les cycliques. Par exemple, imaginez que nous construisons un modèle simple, représentant deux carbones par deux boules de polystyrène reliées par un cure-dent coincé dedans.
Lorsque nous avons un seul cure-dent et que nous tenons l'une des boules, l'autre peut facilement tourner autour de son propre axe, tout comme avec une simple reliure.

Cependant, si nous plaçons un cure-dent supplémentaire reliant les deux sphères, nous ne pourrons pas tenir une sphère et faire pivoter l'autre. Si nous faisons cela, les cure-dents se briseront. De même, lorsqu'il existe une liaison pi et une liaison sigma (double liaison), il existe un obstacle à la rotation des carbones.
Donc, dans le cas ci-dessous, où l'on a une double liaison entre les carbones, il ne s'agit pas de deux isomères conformationnels, c'est-à-dire deux conformations pour la même molécule; nous avons en fait deux diastéréoisomères cis-trans :
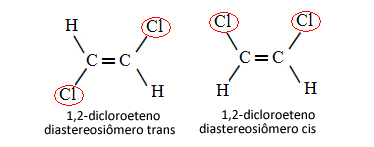
En savoir plus sur ce type d'isomérie dans le texte Isomères géométriques ou cis-trans.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm
