S'il était possible de visualiser très clairement la structure d'un métal, nous le verrions comme dans l'image ci-dessus. La structure atomique des métaux est cristalline, constituée de cations métalliques entourés d'électrons.
Les réseaux cristallins présents dans les métaux peuvent être représentés comme suit :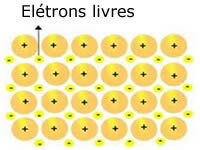
Représentation du sodium métallique (Na)
Les réseaux cristallins des métaux sont formés par un groupe de cations fixes.
Chaque cation Na+ est entouré d'électrons, mais ceux-ci sont délocalisés, c'est-à-dire qu'ils ne sont attirés par aucun noyau.
Comme il n'y a pas d'attraction entre les charges négatives (électron) et le noyau positif (cation), les électrons libres finissent par occuper tout le réseau cristallin du métal. La liberté de mouvement des électrons les amène à former un nuage électronique.
La capacité des métaux à conduire l'électricité s'explique par la présence de ce nuage. Le courant électrique résulte du contact d'électrons libres avec d'autres métaux.
Dans la composition de tout atome, y compris les métaux tels que le sodium (Na), l'or Au, le cuivre (Cu), il existe une couche de valence. Les électrons se déplacent librement à travers cette couche en maintenant l'attraction électromagnétique pour les cations. Cette propriété structurelle permet la formation de molécules métalliques et, par conséquent, des métaux eux-mêmes.
Par Líria Alves
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm