La liaison ionique se produit entre les ions, comme son nom l'indique. Parce qu'ils ont des charges opposées, les cations (élément avec une charge positive) et les anions (élément avec une charge négative) s'attirent électrostatiquement, formant la liaison. Or, un solide ionique est constitué d'un agglomérat de cations et d'anions organisés avec des formes géométriques bien définies, appelés réseaux ou réseaux cristallins.
Par exemple, le sel (chlorure de sodium) est formé par le transfert définitif d'un électron du sodium au chlore, donnant naissance au cation sodium (Na+) et l'anion chlorure (Cl-). En pratique, cette réaction implique non seulement deux atomes, mais un nombre énorme et indéterminé d'atomes qui forment un réseau cristallin de forme cubique, comme indiqué ci-dessous :
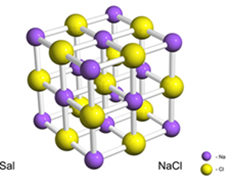
Si nous regardons les cristaux de sel au microscope électronique à balayage, nous verrons qu'ils sont en fait cubiques en raison de leur structure interne.

Puisque tout composé ionique est alors constitué d'un nombre indéterminé et très grand d'ions, comment peut-on représenter un composé ionique ?
La formule habituellement utilisée est la formule unitaire, qui est celui qui représente la proportion exprimée par le plus petit nombre possible de cations et d'anions qui composent le réseau cristallin, de sorte que la charge totale du composé soit neutralisée. Pour que cela se produise, il faut que le nombre d'électrons cédés par un atome soit égal au nombre d'électrons reçus par l'autre atome.
Certains aspects de la formule unitaire des composés ioniques sont importants, voir certains :
- Écrivez toujours le cation en premier, puis l'anion ;
- Étant donné que chaque composé ionique est électriquement neutre, les charges ioniques individuelles n'ont pas besoin d'être écrites ;
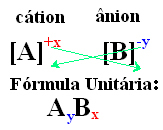
- Les numéros d'indice apparaissant sur le côté droit de chaque ion indiquent le rapport des atomes du cation à l'anion. Ces nombres sont appelés indices et le nombre 1 n'est pas écrit.
Par exemple, dans le cas du chlorure de sodium, nous avons que sa formule unitaire est NaCl, car nous avons exactement 1 cation sodium pour chaque anion chlorure.
Voir un autre exemple, Al3+ a trois charges positives, tandis que le F- il n'a qu'un seul négatif, donc trois anions fluorure sont nécessaires pour neutraliser le composé. Ainsi, nous concluons que sa formule unitaire est AlF3.
Un moyen simple d'arriver à la formule unitaire du composé ionique est d'échanger ses charges contre ses indices, comme indiqué de manière générique ci-dessous :
Exemples:

Une autre formule utilisée pour représenter les substances ioniques est la formule de Lewis ou alors formule électronique, quelle représente les électrons de la couche de valence des ions "boules" autour du symbole de l'élément. Dans le cas du sel, on a :

Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm



