Au familles de tableaux périodiques sont les séquences verticales du tableau et regroupent éléments chimiques avec des propriétés chimiques similaires. De telles similitudes sont dues à la présence de quantités égales d'électrons de valence pour les éléments regroupés dans la même famille. Les familles accueillent les éléments représentatifs dans les groupes 1 et 2, de 13 à 18 et les éléments transitoires dans les groupes 1 à 12.
A lire aussi :Éléments transuraniens - les éléments chimiques artificiels qui viennent après l'uranium dans le tableau périodique
Résumé des familles de tableaux périodiques
Les familles correspondent aux lignes verticales du Tableau périodique.
Aussi appelées groupes, les familles du tableau périodique sont numérotées de 1 à 18.
Les éléments chimiques d'une même famille ont des propriétés chimiques similaires.
La familiarité d'un ensemble d'éléments s'explique par la présence d'un nombre égal d'électrons de valence.
Les éléments représentatifs sont divisés en groupes 1, 2, 13, 14, 15, 16, 17 et 18. Chacune de ces familles porte des noms spécifiques.
Les éléments de transition forment une seule famille qui est divisée en groupes 3, 4, 5, 6, 7, 8, 9, 10, 11 et 12.
Organisation des familles de tableaux périodiques
Familles dans le tableau périodique sont les séquences verticales du tableau, c'est-à-dire les colonnes. Aussi appelées groupes, les familles du tableau périodique sont numérotés de 1 à 18, de gauche à droite.
Les éléments chimiques qui occupent la même colonne sont considérés comme appartenant à la même famille., en raison de la similitude entre leurs propriétés chimiques, qui est due au fait qu'ils ont le même nombre de électrons à coquille de valence. Par exemple, tous les éléments chimiques de la famille 18 ont huit électrons dans la couche de valence (coque complète) et participent rarement à liaisons chimiques.
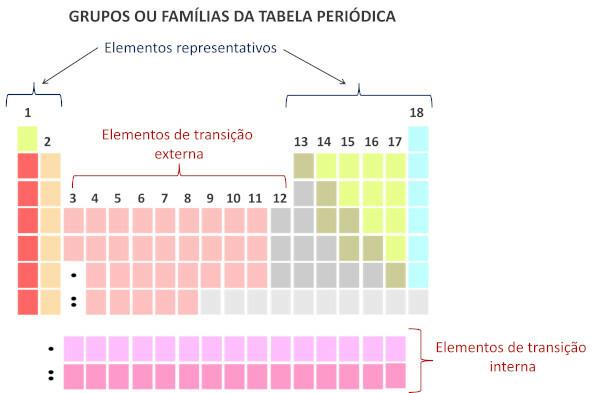
Selon le système moderne de Union internationale de chimie pure et appliquée (Iupac), chaque groupe ou famille est identifié par un numéro de 1 à 18, en commençant de gauche à droite dans le tableau périodique.
Il est important de souligner que l'ancien système IUPAC a adopté un système alphanumérique, avec les lettres A et B pour désigner respectivement les éléments représentatifs et de transition. Actuellement, ce type de nomenclature n'est plus utilisé.
Nomenclature des familles du tableau périodique
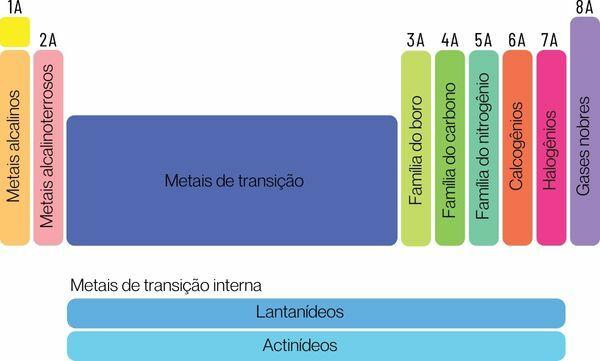
Les éléments chimiques peuvent être classés en deux grandes familles: les éléments représentatifs et les éléments de transition.
→ Éléments représentatifs du tableau périodique
Les éléments représentatifs sont divisés en groupes 1, 2, 13, 14, 15, 16, 17 et 18. Chacun de ces groupes a un nom spécifique, par lequel il peut également être connu. Regarder:
Groupe 1: Famille de les métaux alcalin.
Groupe 2 : Famille de métaux alcalino-terreux.
Groupe 13 : famille des métaux bore ou terre.
Groupe 14 : famille du carbone.
Groupe 15 : Famille de l'azote ou des pnicogènes.
Groupe 16 : famille de l'oxygène ou du chalcogène.
Groupe 17: Famille de halogènes.
Groupe 18 : Famille de gaz nobles.
→ Éléments de transition du tableau périodique
Toi éléments de transitionforment une seule famille divisée en groupes 3, 4, 5, 6, 7, 8, 9, 10, 11 et 12. Les séries des lanthanides et des actinides font également partie des éléments de transition.
Les éléments de transition sont tous métalliques et ont des propriétés chimiques similaires, ayant même des électrons différents dans la couche de valence et, par conséquent, formerait une seule et grande famille de métaux de transition.
Éléments chimiques des familles du tableau périodique
Chaque famille ou groupe est composé d'un ensemble d'éléments chimiques. Voir la description des éléments chimiques qui composent chaque famille :
Groupe 1:lithium, sodium, potassium, rubidium, césium, francium.
Groupe 2 :béryllium, magnésium, calcium, strontium, baryum, radio.
Groupe 3 :scandium, yttrium, série des lanthanides et série des actinides.
Groupe 4: titane, zirconeO, hafnium C'est rutherfordium.
Groupe 5 :vanadium, niobium, tantale C'est dubnium.
Groupe 6 :chrome, molybdène, tungstène C'est seborgium.
Groupe 7 :manganèse, technétium, rhénium C'est bohrio.
Groupe 8: fer, ruthénium, osmium C'est hassium.
Groupe 9 :cobalt, rhodium, iridium et meitnerium.
Groupe 10 :nickel, palladium, platine et darmstadtio.
Groupe 11: cuivre, argent, or et roentgenium.
Groupe 12 :zinc, cadmium, Mercure et Copernic.
Groupe 13: bore, aluminium, gallium, indium et thallium.
Groupe 14: carbone, silicium, germanium, étain, mener et flerovium.
Groupe 15 :azote, phosphore, arsenic, antimoine C'est bismuth.
Groupe 16 :oxygène, soufre, sélénium, tellure, polonium et livermorium.
Groupe 17: fluor, chlore, brome, iode et astate.
Groupe 18 :hélium, néon, argon, krypton, xénon C'est radon.
Important: l'élément chimique hydrogène est un cas particulier, car bien qu'il soit situé à côté du groupe 1, il ne fait pas partie de la famille des métaux alcalins, car il ne partage pas les mêmes propriétés chimiques.
Savoir plus: Quels sont les éléments radioactifs dans le tableau périodique ?
Principales caractéristiques des familles du tableau périodique
→ Groupe 1 ou famille de métaux alcalins
Ce sont des solides métalliques, brillants et lisses.
Ils ont une conductivité thermique élevée et une haute Conductivité électrique.
ont températures fusion relativement faible.
Ils sont très réactifs avec eau.
Tendance à former des cations monovalents (charge +1).
→ Groupe 2 ou famille de métaux alcalino-terreux
Ce sont des solides métalliques, brillants et plus durs que les métaux alcalins.
Ils s'oxydent facilement.
Ils ont une conductivité thermique élevée et une conductivité électrique élevée.
Ils ont des températures de fusion légèrement plus élevées que les métaux alcalins.
Ils sont réactifs avec l'eau.
Tendance à former des cations divalents (charge +2).
→ Groupes 3 à 12 ou famille de métaux de transition
Ils sont la plus grande famille du tableau périodique.
Solides métalliques durs et brillants.
Ils ont une conductivité thermique élevée et une conductivité électrique élevée.
Dense.
Températures de fusion élevées.
peuvent présenter différents états d'oxydation.
→ Groupe 13 ou famille du bore
Ils ont des propriétés intermédiaires entre les propriétés des métaux et pas des métaux.
Ils sont solides dans les conditions ambiantes.
Tendance à former des cations trivalents (charge +3).
→ Groupe 14 ou famille carbone
Ils ont des propriétés intermédiaires entre les propriétés des métaux et des non-métaux.
Ils sont solides dans les conditions ambiantes.
Tendance à former quatre liens.
Ils sont solides dans les conditions ambiantes.
Le carbone et le silicium peuvent former des liaisons en chaîne.
→ Groupe 15 ou famille azotée
Ils ont des propriétés intermédiaires entre les propriétés des métaux et des non-métaux.
Solides dans les conditions ambiantes, à l'exception de l'azote, qui est un gaz.
L'azote et le phosphore sont fondamentaux dans les organismes vivants.
L'arsenic est hautement toxique.
→ Groupe 16 ou famille oxygène (chalcogènes)
Ils ont des propriétés différentes, passant d'un élément non métallique à un élément métallique au fur et à mesure que vous descendez dans la famille.
Solides dans les conditions ambiantes, à l'exception de l'oxygène, qui est un gaz.
Tendance à former des anions divalents (charge -2).
→ Groupe 17 ou famille d'halogènes
Ce sont des non-métaux.
Assez réactif.
Mauvais conducteurs thermiques et électriques.
Dans les conditions ambiantes, le fluor et le chlore existent sous forme des gaz, le brome est liquide et l'iode est solide.
Tendance à former des anions monovalents (charge -1).
→ Groupe 18 ou famille des gaz nobles
Ce sont des non-métaux.
Très peu réactifs, ils peuvent donc être appelés gaz inertes.
Ils existent sous forme de gaz.
Ils n'ont pas tendance à former des ions.
Tableau périodique et distribution électronique
Les éléments chimiques appartenant à la même famille ou au même groupe ont des propriétés chimiques similaires car ils ont nombre égal d'électrons dans la couche de valence.
Le nombre d'électrons dans la couche de valence est pertinent, car il détermine la tendance à la formation de cations ou anions, le type de liaison chimique à former, l'énergie impliquée dans les réactions chimiques, entre autres caractéristiques. Pour trouver le nombre d'électrons de valence, il faut connaître le numéro atomique de l'élément et effectuez votre distribution électronique.
→ Diffusion électronique des éléments représentatifs
Les éléments représentatifs ont leurs électrons les plus énergétiques dans les sous-niveaux s C'est P de la couche électronique (n). Le tableau suivant regroupe les configurations électroniques associées à chaque famille d'éléments représentatifs. le terme n varie de 1 à 7 et représente le niveau d'énergie occupé par les électrons de valence, équivalent à la période (ligne horizontale) du tableau périodique dans laquelle se trouve l'élément.
Diffusion électronique des éléments représentatifs | ||
famille ou groupe |
Distribution électronique |
Exemple |
1 |
nous1 |
Li (Z=3): 1s2 2s1 |
2 |
nous2 |
Être (Z=4): 1s2 2s2 |
13 |
nous2 np1 |
B (Z=5): 1s2 2s22p1 |
14 |
nous2 np2 |
C (Z=6): 1s2 2s22p2 |
15 |
nous2 np3 |
N (Z=7): 1s2 2s22p3 |
16 |
nous2 np4 |
O (Z=8): 1s2 2s22p4 |
17 |
nous2 np5 |
F (Z=9): 1s2 2s22p5 |
18 |
nous2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Distribution électronique des éléments de transition
Les éléments de transition sont répartis entre les groupes 3 et 12 et avoir les sous-niveaux d C'est F occupé par des électrons de valence :
Éléments de transition externes : garder les électrons de valence dans le sous-niveau d, en gardant la configuration électronique égale à nous2 (n-1)d(1 à 8). Par exemple, l'élément nickel (Z = 28) appartient au groupe 10, et sa configuration est 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Éléments de transition internes: ils font partie du groupe 3, mais sont "internes" au tableau périodique des éléments, étant développés en dessous, dans les périodes 6 (lanthanides) et 7 (actinides). Ces éléments ont des électrons de valence occupant la sous-couche F et la configuration électronique générale de nous2 (n-2)f(1 à 13). Par exemple, l'élément lanthane (Z = 57) est le premier élément de la série des lanthanides, et sa configuration électronique est 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
A savoir aussi :Quelle est l'origine du tableau périodique ?
Exercices résolus sur les familles du tableau périodique
question 1
(UFC — adapté) En ce qui concerne la classification périodique moderne des éléments, cochez la vraie déclaration :
A) Dans le tableau périodique, les familles ou groupes correspondent à des lignes horizontales.
B) Les éléments d'une famille ont des propriétés chimiques très différentes.
C) Dans une famille, les éléments ont généralement le même nombre d'électrons dans la dernière couche.
D) Dans une période, les éléments ont des propriétés chimiques similaires.
E) Les éléments représentatifs sont répartis dans les groupes 3 à 12.
Résolution:
Variante C
Le point A est incorrect: les familles ou groupes sont les colonnes (lignes verticales) du tableau périodique.
Item B et D incorrects: Dans une famille, les éléments ont des propriétés chimiques similaires. Dans les périodes, les éléments ont la même couche d'électrons occupée par des électrons de valence.
Item C correct: Dans une famille, les éléments ont le même nombre d'électrons dans la dernière couche.
Item E incorrect: les éléments représentatifs sont les groupes 1, 2, 13, 14, 15, 16, 17 et 18. Les éléments de transition sont répartis dans les groupes 3 à 12.
question 2
(EAM) Les éléments A, B et C ont les configurations électroniques suivantes dans leurs couches de valence :
R: 3 s1
B: 4 s2 4p4
C: 3 s2
Sur la base de ces informations, sélectionnez l'option appropriée.
A) L'élément A est un métal alcalin.
B) L'élément B est un halogène.
C) L'élément C est un chalcogène.
D) Les éléments A et B appartiennent à la troisième période du tableau périodique.
E) Les trois éléments appartiennent au même groupe du tableau périodique.
Résolution:
Variante A
Item A correct: l'élément A a une distribution électronique contenant un seul électron de valence, il appartient donc au groupe 1 du tableau périodique.
Élément B incorrect: l'élément B a une configuration électronique de 4 s2 4p4, indiquant qu'il y a 6 électrons dans la dernière couche et que cet élément appartient au groupe 16 (chalcogènes).
Item C incorrect: l'élément C a une configuration électronique avec 2 électrons dans la dernière couche, c'est donc un élément du groupe 2 dans le tableau.
Item D incorrect: l'élément A appartient à la troisième période (n = 3) et l'élément B appartient à la quatrième période (n = 4).
Item E incorrect: les trois éléments ont des quantités différentes d'électrons dans la dernière couche, ils ne peuvent donc pas faire partie de la même famille.
Par Ana Luiza Lorenzen Lima
Professeur de chimie
Source: École du Brésil - https://brasilescola.uol.com.br/quimica/familias-da-tabela-periodica.htm



