O muscovius, numéro atomique 115, situé dans le groupe 15 du tableau périodique, est l'un des derniers éléments qui y sont inclus, en 2015, avec les éléments 113, 117 et 118. Son nom fait référence à la région de Moscou, capitale russe.
Moscovium, cependant, a été initialement produit, en 2003, grâce au travail conjoint de scientifiques russes et américains. Pourtant, près de 20 ans après sa synthèse initiale, ses propriétés fondamentales sont encore en cours de détermination. Ainsi, on spécule beaucoup et on sait peu de choses sur ses propriétés.
Savoir plus: Noms des nouveaux éléments chimiques - les hommages aux villes, aux régions et aux scientifiques
résumé sur moscovius
C'est un élément chimique synthétique situé dans le groupe 15 de Tableau périodique.
Il a été synthétisé pour la première fois, en 2003, grâce à un travail conjoint entre scientifiques russes et américains.
Il constitue le groupe d'éléments le plus récemment inclus dans le tableau périodique, en 2015.
Leurs études sont très récentes, les propriétés de base étant encore en cours de détermination.
Sa production se fait par fusion nucléaire, en utilisant 48Ca et atomes de 243Suis.
Propriétés de Moscou
Symbole: Mc
Numéro atomique: 115
Masse atomique: 288 au.m.a (non officiel par Iupac)
Configuration électronique: [Rn] 7s2 5f14 6d10 7p3
Isotope le plus stable: 288Mc (demi-vie de 0,159 seconde)
série chimique: groupe 15, éléments superlourds
Caractéristiques de la Moscovie
le muscovius est un des derniers éléments incluss dans le tableau périodique. Son inclusion a eu lieu le 30 décembre 2015 et son nom officiel a été publié le 8 juin 2016.
Jusqu'à cette date, l'élément 115 était connu en portugais sous le nom de ununpentio, du latin, unpentium, dont la traduction est "un, un, cinq". Une autre nomenclature adoptée était eka-bismuth, qui signifie "semblable au bismuth", élément de la sixième période du groupe 15.
La Moscovie est un élément synthétique, ce qui signifie qu'il ne peut être produit qu'en laboratoire. Ceci est très courant chez les éléments superlourds car leur noyau, avec de nombreux protons et neutrons, ne peut pas se stabiliser, ce qui les rend impossibles à trouver dans la nature.
pour être un élément instable, lui et les autres éléments superlourds finissent par subir une désintégration radioactive presque instantanément - émissions de particules éléments nucléaires (tels que les particules α ou β) - et la transformation qui en résulte en d'autres éléments plus légers, qui peuvent être stables ou Non.
A son sujet, il faut préciser que ses études sont encore très récentes, après tout, nous sommes face à un élément produit il y a un peu moins de 20 ans et dont le statut officiel n'a même pas 10 ans. À cet égard, les scientifiques se sont davantage préoccupés de déterminer les caractéristiques de base, telles que leur masse atomique et son comportement chimique dans certains composés possibles.
Par exemple, la masse atomique la plus probable détectée jusqu'à présent pour la muscovy est de 288 unités de masse atomique. Sans compter que l'obtention du muscovium est très compliquée, avec un revenu d'un seul atome par jour.
De plus, l'atome produit ne peut pas toujours être capturé pour mesurer la masse. En 2018, des chercheurs des laboratoires de Berkeley, en Californie, aux États-Unis, n'ont pu mesurer qu'une seule masse par semaine. Ainsi, les études sur les propriétés de ses composés sont encore du domaine de la chimie théorique, avec des calculs et des modèles mathématiques pour déterminer les résultats attendus.
Obtention de la Moscovie
L'obtention du moscovium se fait par La fusion nucléaire. des ions de 48Ici11+ (Z = 20) atomes frappés accélérés de 243Am (Z = 95), disposé sous la forme d'AmO2 sur une cible circulaire titane de 32 cm², produisant le moscovium (Z = 115) et trois neutrons.
Après l'impact, en une microseconde environ (10-6 seconde), l'atome de muscovy frappe le détecteur, qui est à environ quatre mètres du site de collision. Sur ce chemin, l'élément passe également par un séparateur, de sorte que les produits de réaction plus légers sont déviés. Dans le détecteur, le muscovium est détecté par son schéma de désintégration radioactive.
Le moscovium, en tant qu'atome radioactif, subit une désintégration alpha (une particule radioactive avec deux protons et deux neutrons), produisant ainsi l'élément 113 (nihonium, Nh) en élément 105 (dubnium, Db). Enfin, la Db se transforme en rutherfordium (Rf), qui se scinde rapidement en deux fragments. Le schéma de décomposition du moscovium est illustré ci-dessous.
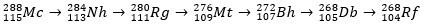
histoire de moscou
le muscovius était synthétisé pour la première fois en 2003, entre le 14 juillet et le 10 août, grâce au travail conjoint des scientifiques du Joint Institute pour la recherche nucléaire à Dubna, en Russie, et le Lawrence Livermore National Laboratory à Livermore, Californie.
des ions de 48Ca pour qu'ils puissent entrer en collision avec des atomes de 243Am, produisant initialement l'isotope 291Mc. Au cours du processus, le noyau a été chauffé à un incroyable 4 x 1011 K, puis refroidi par l'émission très rapide de trois neutrons et de rayons gamma.

Cette action a formé l'isotope 288Mc. puis le moscovius a été détecté et analysé sur la base de son schéma de désintégration radioactive (désintégrations alpha). Le nom de Moscou est un hommage à la région de Moscou, Russie.
A lire aussi :Seaborgium - l'élément chimique synthétique nommé d'après le scientifique Glenn Seaborg
Exercices résolus sur muscovius
question 1
Moscovium, un élément récemment découvert, a été placé dans le groupe 15 du tableau périodique. Sur la base des autres éléments de ce groupe, l'hydrure attendu pour cet élément serait :
A) McH
B) McH2
C) McH3
D) McH4
E) Mc2H3
Résolution:
Variante C
D'autres éléments du groupe 15, tels que azote C'est phosphore, présenter les formules NH3 et pH3 lorsqu'il est lié à l'hydrogène. Ainsi, on s'attend à ce que le moscovium présente la formule McH3 aussi.
question 2
En 2003, le moscovium (Z = 115) a été synthétisé pour la première fois, grâce au travail conjoint de scientifiques russes et américains. A l'époque, l'isotope 288Mc a été détecté et sa production était essentielle pour placer cet élément dans le tableau périodique. Le nombre de neutrons dans cet isotope est :
A) 115
B) 288
C) 403
D) 173
E) 170
Résolution:
Variante D
Le nombre de neutrons peut être calculé comme ceci :
A = Z + n
Où A est le nombre de masse, Z est le numéro atomique et n est le nombre de neutrons. En substituant les valeurs, on obtient :
288 = 115 + n
n = 288 – 115
n = 173
Par Stefano Araujo Novais
Professeur de chimie


