Au fonctions azotées sont un groupe de composés organiques qui ont des atomes de azote attaché à la chaîne carbonée. Ils se distinguent par leurs groupes fonctionnels respectifs, qui sont des ensembles d'atomes connectés dans une certaine configuration et qui définissent les propriétés caractéristiques de chaque fonction.
Les fonctions azotées sont :
amines;
amides;
composés nitrés;
nitriles;
isonitriles.
A lire aussi :Quelles sont les fonctions de l'oxygène ?
Thèmes de cet article
- 1 - Synthèse des fonctions azotées
- 2 - Leçon vidéo sur les fonctions azotées
- 3 - Quelles sont les fonctions azotées ?
-
4 - Quelles sont les fonctions azotées ?
- amines
- Amides
- composés nitrés
- nitriles
- isonitriles
- 5 - Applications des fonctions azotées
- 6 - Exercices résolus sur les fonctions azotées
Résumé des fonctions de l'azote
Les fonctions azotées sont des composés organiques qui contiennent atomes d'azote.
Les amines, les amides, les composés nitrés, les nitriles et les isonitriles sont les fonctions azotées.
Les fonctions inorganiques se distinguent par leur groupe fonctionnel.
Les amines sont dérivées de la substitution de hydrogènes d'ammoniac par des radicaux alkyles.
Les amides ont le même atome de carbone lié à l'azote et au carbone. oxygène.
Les composés nitrés contiennent le groupe -NO.2.
Les nitriles sont caractérisés par la présence d'une triple liaison entre le carbone et l'azote.
Les isonitriles ont une triple liaison entre l'azote et carbone, avec de l'azote attaché à la chaîne carbonée.
Leçon vidéo sur les fonctions azotées
Que sont les fonctions azotées ?
Les fonctions de l'azote sont un ensemble de fonctions organiques qui ont l'atome d'azote dans leur structure, en plus des atomes de carbone et d'hydrogène. Ce sont: les amines, les amides, les composés nitrés, les nitriles et les isonitriles,
Ce qui différencie les fonctions azotées, ce sont les groupes fonctionnels respectifs, qui sont l'arrangement structurel des atomes responsables des propriétés de la substance.
Ne vous arrêtez pas maintenant... Y'en a plus après la pub ;)
Quelles sont les fonctions azotées ?
amines
La fonction organique la mine est caractérisé en liant au moins une chaîne carbonée à l'atome d'azote. Le groupe fonctionnel des amines est -N-R1R2R3 (les groupes R sont des chaînes carbonées ou des atomes d'hydrogène dont au moins un est une chaîne carbonée).

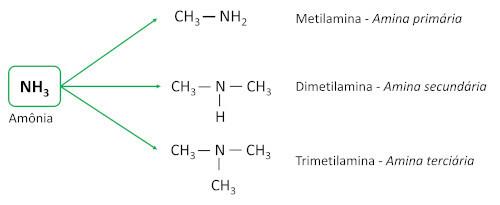
les amines sont dérivés de l'ammoniaque (NH3), avec un ou plusieurs atomes d'hydrogène remplacés par des atomes de carbone ou des ligands alkyle. Ce sont des substances de base, laissant le pH supérieur à 7 en solution aqueuse.
Ils sont classés en fonction de la quantité d'atomes d'hydrogène remplacés par des ligands carbonés (groupes alkyle ou aryle), appelés substituants.
- Amines primaires : ont un seul substituant carboné.
- Amines secondaires : ont deux substituants carbonés.
- Amines tertiaires : ont trois substituants carboniques, c'est-à-dire que l'atome d'azote n'est plus lié à aucun atome d'hydrogène, établissant trois Connexions simple avec des atomes de carbone.
UN nomenclature des amines suit les directives de IUPAC (Union Internationale de Chimie Pure et Appliquée). Dans le cas des amines primaires, la construction du nom prend en compte le nombre de carbones (préfixe), la nature de la liaison entre les carbones (infixe) et le terme est utilisé la mine pour le suffixe (fin de mot).

Voir l'exemple :
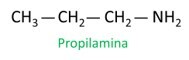
Lorsque vous attribuez des numéros aux carbones pour l'emplacement des radicaux, attribuez le numéro le plus bas possible à l'atome le plus proche du groupe NH.2.
Pour les amines secondaires et tertiaires, la nomenclature considère le groupe substituant le plus long attaché à l'azote comme chaîne principale, et les autres ligands sont écrits avec le préfixe faisant référence au nombre de carbones et le suffixe -il, avec la lettre N devant eux.

Exemple:
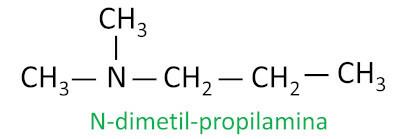
Amides
La fonction organique amide est caractérisé par lier un groupe carbonyle (C=O) à l'atome d'azote, où l'azote peut être lié à des atomes de carbone ou d'hydrogène.
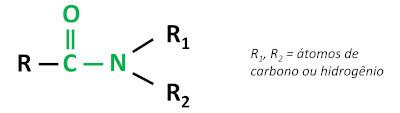
les amides sont des substances de base, laissant le pH supérieur à 7 en solution aqueuse. La substance urée appartient au groupe des amides et est un composé naturellement présent dans l'urine, dérivé des processus de dégradation qui se produisent dans les organismes vivants.
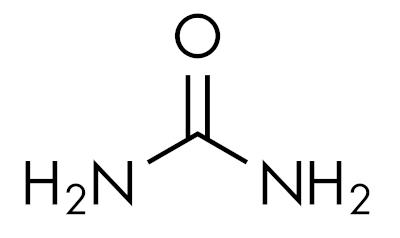
Les amides sont caractéristiques en fonction du niveau de substitution de l'azote. Comme ça:
- Amides primaires: tenir deux atomes d'hydrogène ensemble avec de l'azote.
- Amides secondairesou monosubstitué: un des hydrogènes a été remplacé par chaîne de carbone, donc l'azote maintient une liaison simple avec l'hydrogène.
- amides tertiairesou déplacé: L'azote n'a plus de liaisons hydrogène, qui ont toutes été remplacées par des carbones.

Les amides sont Nommé selon l'IUPAC, les molécules étant nommées par la séquence :

Dans l'amide ramifié, l'atome de carbone du groupe amide participe à la chaîne principale et le nombre de carbone doit commencer par lui. Regarder:
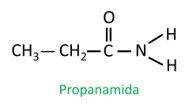 |
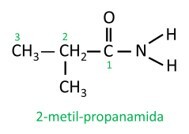 |
Dans les amides monosubstitués ou disubstitués, le la lettre N indique la position de la branche qui est attaché à l'atome d'azote. S'il existe un autre radical dans la chaîne, il sera écrit après avoir identifié le radical faisant référence à N.
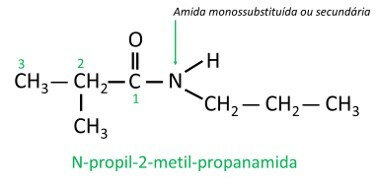
composés nitrés
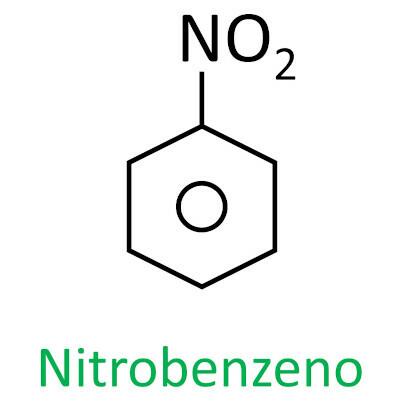
Toi composés nitrés sont des composés organiques qui contiennent un groupe nitro (-NO2) attaché à une chaîne carbonée, qui peut être aliphatique (ouvert ou linéaire) ou aromatique.
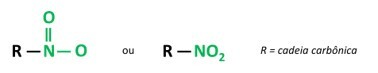
UN caractéristique principale de ces substances est leur pouvoir explosif. La capacité explosive est associée aux composés nitrés aromatiques, et plus le nombre de groupes nitro est élevé, plus l'explosion est importante. Les composés nitrés aliphatiques sont utilisés dans les laboratoires comme solvants organiques.
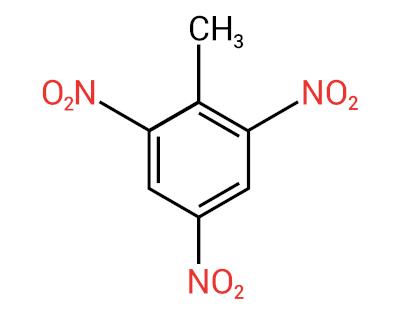
La nomenclature de ces composés est formée par le mot nitro suivi du nom de hydrocarbure (préfixe + infixe + terminaison -O).
Voir quelques exemples :
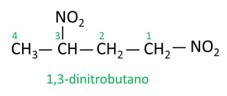 |
 |
nitriles
Les nitriles sont des composés organiques caractérisés par la triple liaison entre un atome de carbone et un atome d'azote, présentant le groupe fonctionnel – C ≡ N. Dans les nitriles, l'azote est à l'extrémité et le carbone est attaché directement à la chaîne carbonée.

les nitriles Aussi connu sous le nom de cyanures, car ils dérivent de réactions avec l'acide cyanhydrique (HCN).
ce sont des substances toxique pour l'homme, car dans le corps, ils peuvent former de l'acide cyanhydrique au contact de l'acide gastrique, empêchant les processus de respiration cellulaire des cellules.
Dans la nature, les nitriles peuvent être trouvés dans certains fruits à noyau, mais en très faible concentration, ne présentant pas de risques, et dans les feuilles de manioc sauvage.

La règle Iupac pour la nomenclature des nitriles définit que le terme nitrile être ajouté comme suffixe :

Voir quelques exemples :
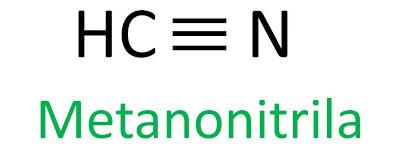 |
 |
La forme habituelle de la nomenclature des nitriles est cyanure + nom du radical.
isonitriles
Les isonitriles, ou isonitriles, sont des composés formés par la triple liaison entre un atome de carbone et un atome d'azote, présentant le groupe fonctionnel – R ≡ C. Dans les isonitriles, le carbone est en bout et l'azote est fixé directement sur la chaîne carbonée.

Les isonitriles diffèrent des nitriles par la position des atomes d'azote et de carbone, et Dans les isonitriles, l'azote est caractérisé comme un hétéroatome., car il est positionné entre deux carbones.
Ce sont des espèces instables et peuvent se transformer en nitriles à des températures élevées. Les réactions de l'acide isocyanidique donnent naissance à des isonitriles, c'est pourquoi ces composés sont également appelés isocyanures.
Les molécules d'isonitrile suivent la règle Iupac pour la dénomination :
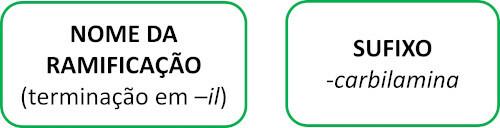
Voir quelques exemples :
 |
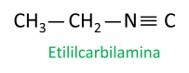 |
Applications des fonctions azotées
Les substances appartenant aux fonctions azotées ont de nombreuses applications, principalement dans le domaine industriel, pour la fabrication de polymères, caoutchouc, fibres synthétiques, produits pharmaceutiques, agrochimiques, pesticides et explosifs.
Au les amines sont utilisées dans la production de colorants, savons, médicaments, en cours de vulcanisation du caoutchouc, des explosifs et d'autres processus industriels, et sont également présents dans les plantes et formés dans les processus de décomposition de la matière organique.

Au les amides ont une large application dans le secteur industriel et chimique, étant présent dans la production de polymères (tels que le nylon et le polyuréthane), de résines, d'explosifs, les engrais, insectifuges, engrais et médicaments.

Toi composés nitrésSon application principale est la fabrication d'explosifs. qui sont utilisés dans le secteur militaire, industriel et métallurgique (pour l'extraction des matières premières). L'un des composés nitrés les plus connus est le trinitrotoluène, communément appelé TNT. D'autres applications des composés nitrés sont dans la production de pesticides, bactéricides, colorants, raffinage du pétrole, etc.

Au les nitriles sont utilisés comme solvants organiques en laboratoire et dans l'industrie, participant aux procédés d'extraction et de fabrication de certaines fibres synthétiques, polymères plastiques, colorants et engrais.

Au les isonitriles sont utilisés dans divers procédés de production de composés organiques, comme les solvants, et participent à la fabrication de produits agrochimiques, de pesticides, de caoutchoucs et de plastiques.
A lire aussi :Halogénures - substances qui ont des atomes d'halogène attachés à la chaîne carbonée
Exercices résolus sur les fonctions azotées
question 1
(FPS-PE-modified) L'application des composés azotés en chimie organique de synthèse est très diversifiée et implique la préparation de médicaments, de colorants, d'explosifs et de vitamines. Regardez les composés ci-dessous.
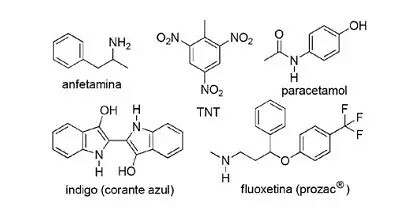
À propos de ces composés, marquez la déclaration incorrecte.
a) Le TNT est un composé nitré.
b) La partie azotée de la fluoxétine est une amine secondaire.
c) L'amphétamine est classée comme amide primaire.
d) L'indigo a des anneaux hétéroaromatiques dans sa structure.
e) La partie azotée du paracétamol est un amide.
Résolution:
Lettre C
L'article Le est correct, car le TNT est un composé nitré car il n'a AUCUN groupe2.
L'article B est correct. La partie azotée de la fluoxétine est une amine secondaire car elle est liée à deux segments carbonés.
L'article w est incorrect, car l'amphétamine est classée comme une amine primaire et non comme un amide. Notez que le groupe actuel est NH2. Voilà donc l'essentiel de la question.
L'article d est correct, car l'indigo a des anneaux hétéroaromatiques dans sa structure, c'est-à-dire des anneaux formés par des atomes de carbone et un autre élément - dans ce cas, l'azote.
L'article C'est est correct, car le paracétamol est un amide, présentant du carbone lié à l'azote et à l'oxygène.
question 2
(UFMS) Yerba maté (Ilex paraguariensis), originaire d'Amérique du Sud, est utilisé comme boisson tonique et stimulante. Le produit obtenu par la transformation des feuilles de yerba maté peut être utilisé pour préparer chimarrão et tereré, entre autres boissons couramment et culturellement consommées dans les régions d'Argentine, du Paraguay et Brésil. Le grand intérêt du yerba maté est dû aux composés chimiques présents, en raison de ses propriétés antioxydantes, stimulantes et diurétiques.
(Disponible en: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Consulté le: 01 nov. 2018. Adapté).
Les propriétés stimulantes du yerba maté sont liées à sa teneur en méthylxanthines, l'une des principales étant la caféine, structure présentée ci-dessous :

Lors de l'analyse de la formule structurelle de la caféine, il est correct d'affirmer qu'elle possède les fonctions et propriétés organiques suivantes :
a) aldéhyde et amide, basique.
b) amine et amide, alcalin.
c) amine et cétone alcaline.
d) cétone et amide, amphotère.
e) acide carboxylique et amine, basique.
Résolution:
La lettre B
En analysant la structure de la caféine, les groupes fonctionnels amine et amide sont identifiés, comme le montre l'image ci-dessous. Comme ces deux groupes ont une caractéristique basique ou alcaline, la caféine possède également cette caractéristique, ce qui signifie que les solutions aqueuses de caféine ont un pH supérieur à 7.
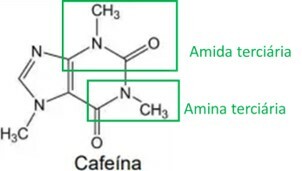
Par Ana Luiza Lorenzen Lima
Professeur de chimie
En savoir plus sur les classifications des amides en fonction de leurs substituants. Apprenez comment la nomenclature du composé est faite et ses principales applications.
Amines, classification des amines, propriétés des amines, amine primaire, composés azotés organiques, radicaux alkyles, diméthylamine, éthylamine, triméthylamine, composés extraits de végétaux, putrescine, cadavérine, bases organiques, synthèses BIO
Apprenez à trier cet élément dans une chaîne.
Connaître la composition chimique, les sources de production et les applications de nombreux composés organiques, tels que l'acétone, l'alcool, l'éther, entre autres.
Les nitriles sont une classe de composés organiques caractérisés par la présence du groupe fonctionnel -CN.
Observez les principales caractéristiques des composés nitrés aromatiques et aliphatiques et quelles sont les règles à respecter dans leur nomenclature officielle.
Découvrez comment la Nomenclature IUPAC a été créée, quels sont ses principaux objectifs et apprenez les règles de base à suivre pour nommer les composés organiques.
Apprenez pas à pas comment nomenclaturer les branches des composés organiques.
TNT signifie trinitrotoluène, dont le nom chimique est 2-méthyl-1,3,5-trinitrobenzène.


