UN sublimation C'est un changement d'état physique de la matière caractérisé par le passage direct de la phase solide à la phase gazeuse, sans passer par la phase liquide. À proprement parler, toute substance peut subir une sublimation, mais dans des conditions spécifiques de pression et de température. La sublimation est corrélée à la pression de vapeur dans la phase solide, ainsi qu'aux interactions intermoléculaires exercées par les solides.
Ce processus peut être facilement observé dans un morceau de neige carbonique, qui se compose de dioxyde de carbone solide. Le dioxyde de carbone se sublime sous pression et à température ambiante. Le processus opposé à la sublimation peut être appelé resublimation ou déposition. Pour que la sublimation se produise, la matière doit absorber de l'énergie, elle est donc considérée comme un processus endothermique.
A lire aussi: Quels sont les états physiques de la matière ?
Résumé sur la sublimation
La sublimation est le passage direct de la phase solide à la phase gazeuse, sans passer par la phase liquide.
Des conditions spécifiques de pression et de température sont nécessaires pour observer la sublimation d'une substance.
La sublimation est influencée par des aspects thermodynamiques, tels que la pression de vapeur dans la phase solide et les interactions intermoléculaires.
La sublimation est un processus endothermique.
Un exemple de sublimation est ce qui se produit dans la neige carbonique, qui se compose de dioxyde de carbone solide.
Qu'est-ce que la sublimation ?
la sublimation est le passage direct de la phase solide à la phase gazeuse, sans passer par la phase liquide. Il se produit dans des conditions spécifiques de température et de pression pour certains solides. Cette transition est un processus physique de changement d'état, n'impliquant pas de réactions chimiques.
Le processus inverse, c'est-à-dire le passage direct de la phase gazeuse à la phase solide, est diversement appelé. Certains auteurs gardent le mot sublimation pour ce changement de phase, tandis que d'autres utilisent « resublimation » et même « dépôt ».
Comment fonctionne la sublimation
Un parallèle peut être établi entre la sublimation et l'évaporation. Dans les deux cas, le point final est phase gazeuse. La différence, évidemment, se situe dans la phase de démarrage: solide pour la sublimation et liquide pour l'évaporation.
Dans les deux cas, il y a influence de la pression dévaporisation ainsi que les aspects thermodynamiques, impliquant la chaleur et les interactions intermoléculaires.
Qu'est-ce que la pression de vapeur ?
Dans un récipient fermé contenant un liquide, on peut percevoir qu'il y a un équilibre entre la phase liquide et la phase vapeur. En effet, même en dessous de la température d'ébullition, l'énergie présente est suffisante pour que certaines molécules du liquide se détachent et passent dans la vapeur. Cependant, certaines molécules de vapeur peuvent également se condenser à nouveau et retourner en phase liquide, ce qui démontre la réversibilité du processus.
Cette vapeur, étant constituée de matière (a une masse et un volume), des exercices pression à la surface du liquide, connue sous le nom de pression de vapeur. Elle ne dépend pas de la quantité de liquide, mais de la température, car plus la température est élevée, plus les molécules se détachent facilement de la phase liquide.
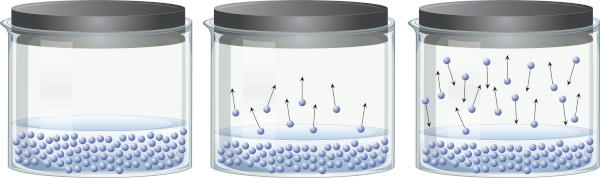
Les liquides qui ont une pression de vapeur élevée à des températures ordinaires sont appelés volatils. Par exemple, à 25°C, l'éther éthylique a une pression de vapeur de 0,58 atm, l'acétone (propanone) a une pression de vapeur de 0,29 atm, tandis que l'eau a une pression de vapeur de 0,023 atm. D'ailleurs, lorsque la pression de vapeur est identique à la pression atmosphérique, le liquide bout. Pour en savoir plus sur la pression de vapeur, cliquez sur ici.
Pression de vapeur et sublimation
Bien que dans une moindre mesure, les solides ont aussi une pression de vapeur, mais bien inférieur à celui des liquides. Par exemple, même à une température de 1000 K, la pression de vapeur du fer n'est que de 9,21 x 10-20 au m. Cependant, certains solides parviennent à subir une sublimation, comme l'iode, présentant une pression de vapeur plus élevée aux températures normales (4 x 10-4 au m).
Ceci n'est possible qu'avec le passage des molécules de l'état solide directement à l'état gazeux. Pour que cela se produise, le les molécules du solide doivent présenter interactions intermoléculaires faible (dans l'iode, par exemple, ils sont du type dipôle induit-dipôle induit).
On voit aussi que le processus de sublimation est endothermique, c'est-à-dire que les molécules du solide ont besoin d'absorber de l'énergie sous forme de chaleur pour rompre les interactions intermoléculaires et passer à l'état de vapeur. La quantité de chaleur impliquée peut être mesurée par une quantité thermodynamique connue sous le nom d'enthalpie de sublimation.
Diagramme des phases
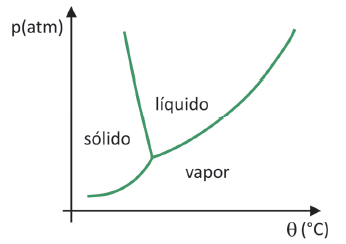
Pour savoir dans quelle gamme de pression et de température la sublimation d'un solide va se produire, vous devez évaluer votre diagramme de phase. Prenons le cas du dioxyde de carbone, CO2.

Dans un diagramme de phase, les lignes de démarcation entre les états (solide, liquide et gaz) rassemblent les valeurs de pression et de température pour un changement d'état se produit. En observant le cas du CO2, on remarque qu'à 1 atmosphère de pression, la phase solide passe directement à la phase vapeur à une température de -78,5 °C, ce qui caractérise une sublimation.
Le dioxyde de carbone n'a une phase liquide qu'à des pressions supérieures à 5,11 atmosphères, et au-delà de cette pression, la sublimation n'est plus possible. Pour en savoir plus sur le diagramme de phase, cliquez sur ici.
exemples de sublimation
Glace carbonique: la neige carbonique, souvent utilisée pour créer des effets de brouillard lors de fêtes et d'événements, est en fait du dioxyde de carbone à l'état solide.

boules de naphtaline: les boules de naphtaline sont fabriquées à partir de naphtalène, un composé organique aromatique. Il est appliqué pour éliminer les mauvaises odeurs et aussi effrayer les mites, les cafards et autres animaux venimeux, c'est pourquoi il est courant qu'ils soient utilisés dans les placards ou même les urinoirs.

Camphre: Avec une odeur caractéristique, les galets de camphre peuvent également subir une sublimation. Ils servent également à effrayer les moustiques et à prévenir les moisissures.

Iode: le non-métal appartenant aux halogènes subit également une sublimation.

Cependant, parmi les substances présentées, seul le dioxyde de carbone subit une sublimation dans des conditions ambiantes. Les autres, même avec sublimation, peuvent subir une fusion normale sous la pression dans laquelle nous vivons.
A lire aussi: Plasma — le quatrième état de la matière
Exercices résolus sur la sublimation
question 1
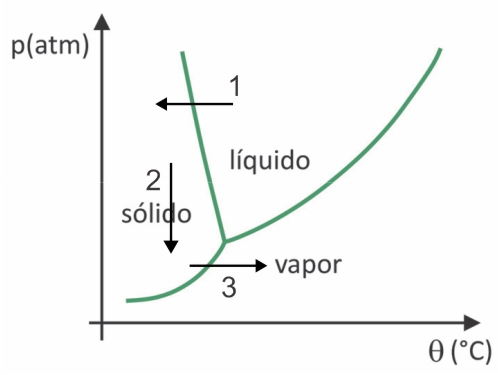
(Fuvest 2020) Dans les supermarchés, il est courant de trouver des aliments dits lyophilisés, comme les fruits, les légumes et la viande. Les aliments lyophilisés peuvent encore être consommés après une longue période, même sans réfrigération. Le terme « lyophilisé » dans ces aliments fait référence au processus de congélation et à la déshydratation subséquente par sublimation dans l'eau. Pour que la sublimation de l'eau se produise, une combinaison de conditions est nécessaire, comme le montre le graphique pression-température, où les lignes représentent les transitions de phase.
Bien qu'il s'agisse d'un processus qui nécessite, sur le plan industriel, l'utilisation de certaines technologies, il est prouvé que les peuples les précolombiens qui vivaient dans les régions les plus hautes des Andes pouvaient lyophiliser les aliments, ce qui permettait de les stocker pour plus de temps. Vérifiez l'alternative qui explique comment le processus naturel de lyophilisation s'est produit :
a) La sublimation de l'eau s'est produite en raison des basses températures et de la pression atmosphérique élevée dans les montagnes.
b) La nourriture, après avoir été naturellement congelée pendant les périodes froides, était transportée dans la partie la plus basse des montagnes, où la pression atmosphérique était plus basse, ce qui rendait possible la sublimation.
c) Les aliments ont été exposés au soleil pour augmenter la température, et la faible pression atmosphérique locale a favorisé la solidification.
d) Les températures étaient suffisamment basses pendant les périodes froides pour congeler les aliments, et la faible pression atmosphérique dans les hautes montagnes rendait possible la sublimation.
e) Les aliments, après avoir été naturellement congelés, ont été pressés pour augmenter la pression, afin que la sublimation puisse se produire.
Réponse: Lettre D
Dans la lyophilisation, il y a la congélation de l'eau avec sa sublimation ultérieure. Les peuples précolombiens pouvaient réaliser un tel processus, car en hiver l'eau pouvait geler (flèche 1) et, avec les basses pressions (flèche 2) des régions les plus hautes des Andes, il pourrait subir une sublimation (flèche 3).
question 2
(Uerj 2005) La neige carbonique, ou dioxyde de carbone solidifié, largement utilisé dans les processus de réfrigération, subit une sublimation dans des conditions ambiantes. Au cours de cette transformation, les phénomènes de variation d'énergie et de perturbation des interactions se produisent, entre autres.
Ces phénomènes sont classés, respectivement, comme suit :
a) exothermique - interionique
b) exothermique - internucléaire
c) isotherme - interatomique
d) endothermique - intermoléculaire
Réponse: Lettre D
La sublimation est un processus endothermique, car elle nécessite l'absorption de chaleur pour perturber les interactions qui maintiennent les molécules en phase solide compactes. Ces interactions sont de type intermoléculaire.
Par Stefano Araujo Novais
Professeur de chimie