LA oganesson, symbole Og, numéro atomique 118, est l'élément chimique avec le numéro atomique le plus élevé dans le tableau périodique jusqu'à présent. Il est introuvable dans la nature et sa production est artificielle, il est donc considéré comme un élément synthétique. Même ainsi, sa production est très difficile et il est considéré comme un élément très rare, ayant été synthétisé très peu de fois.
Bien qu'il soit dans le même groupe que le gaz nobles, oganesone n'a pas beaucoup de caractéristiques qui se réfèrent à ces éléments, selon les calculs démontrent les mathématiciens, comme conséquence des effets relativistes dont souffrent les éléments superlourds.
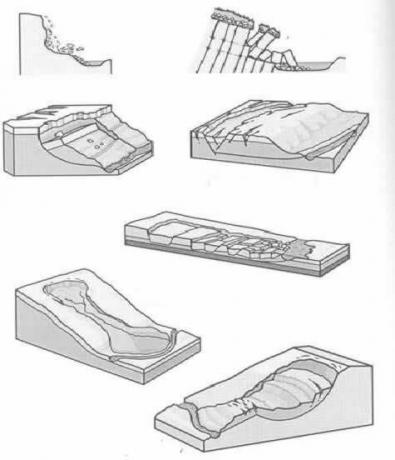
L'élément 118 a été synthétisé pour la première fois en 2002, par la réaction d'ions 48Ca avec des atomes de 249Voir Son nom est un hommage au scientifique russe Yuri Oganessian, l'un des plus respectés et reconnus dans le domaine des éléments superlourds.
Voir aussi: Rutherfordium - l'élément chimique synthétique nommé d'après le scientifique Ernest Rutherford
Résumé sur oganesson
L'Oganessone est un élément chimique synthétique situé dans le groupe 18 de la Tableau périodique.
Il a été synthétisé pour la première fois en 2002, dans un travail conjoint entre des scientifiques russes et américains.
Il constitue le groupe d'éléments le plus récemment inclus dans le tableau périodique, en 2016.
C'est un élément très rare, ayant été synthétisé très peu de fois.
Leurs études sont encore très récentes, les propriétés de base étant encore déterminées par des calculs et des modèles mathématiques.
Des tests théoriques préliminaires indiquent que, malgré son appartenance au groupe des gaz nobles, certaines propriétés éloignent Og des autres éléments.
La production d'oganesone se fait par La fusion nucléaire, en utilisant des ions de 48Ca et atomes de 249Voir
Son nom est un hommage au scientifique russe Yuri Oganessian, l'un des plus importants dans le domaine de l'étude des éléments superlourds.
propriétés de l'oganesson
Symbole: oh
Numéro atomique: 118.
Masse atomique: 294 cu (non officiel par Iupac).
Configuration électronique: [Rn] 7s2 5f14 6d10 7p6.
Isotope le plus stable: 294Og (demi-vie de 0,69 milliseconde, qui peut être augmentée de 0,64 milliseconde ou réduite de 0,22 milliseconde).
Série chimique: groupe 18, éléments superlourds, gaz nobles.
Caractéristiques de l'oganesson
Oganesson est le élément de numéro atomique le plus élevé (118) rendu officiel jusqu'à présent par l'Union internationale de chimie pure et appliquée (IUPAC). Bien qu'il ait été produit pour la première fois en 2002, on sait peu de choses sur lui. Beaucoup est encore spéculé, car cet élément ne se trouve pas dans la nature. Sa production est réalisée en laboratoire, qui le configure comme un élément synthétique.
En outre, ton demi-vie est inférieur à une milliseconde (10-3 deuxième) - en se rappelant que la demi-vie est le temps nécessaire pour que la quantité diminue de moitié. Par conséquent, les propriétés qui sont stipulées pour cet élément ne sont rien d'autre que les résultats de calculs théoriques basés sur des modèles mathématiques, car dans la région du tableau périodique dans laquelle il est trouve le effets relativistes (l'écart entre les effets attendus et observés en raison de la relativité) sont importants.
Les effets relativistes éloignent Og de ce qu'on attendait de lui. L'élément, par exemple, n'a pas un comportement similaire aux gaz nobles. Les calculs montrent que l'oganesone serait un solide à température ambiante, avec un point de fusion dans la gamme de 325 ± 15 K (environ 52 °C) et un point d'ébullition dans la gamme de 450 ± 10 K (environ 177 °C).
On sait également que l'Og peut être plus réactif que les autres gaz nobles, car les effets relativistes lui permettent de perdre plus facilement des électrons de sous-niveau p. Un autre point de désaccord avec les gaz nobles est que l'oganesone est un semi-conducteur, tandis que les autres sont des isolants.
A lire aussi: Hydrogène - l'élément chimique qui a le numéro atomique le plus bas dans le tableau périodique
Obtention d'oganesson
Comme d'autres éléments superlourds, l'oganesson est obtenu grâce à une technique appelée thermofusible, où les ions de l'isotope 48Ca, présent naturellement mais très peu disponible, réagit avec des isotopes beaucoup plus lourds pour produire les éléments superlourds.
Og est un élément tellement rare et difficile à obtenir que En dix ans, seulement quatre atomes vient d'être produit. Fondamentalement, la production de 294Og, le seul isotope connu, se produit par bombardement d'ions 48Ca à un noyau de 249Cf, avec dégagement de 3 neutrons.
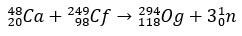
Avec quelques millisecondes de demi-vie, l'Og a été identifié par son mode de décomposition, quelque chose de très courant pour les éléments super-lourds. Dans ce cas, des désintégrations 3 alpha se sont produites, provoquant la transformation de l'élément 118 en copernicium, Cn, qui a finalement subi une fission spontanée.
histoire d'oganesson
La première synthèse d'oganesone a eu lieu en 2002., dans la ville de Livermore, Californie, États-Unis, au Lawrence Livermore National Laboratory, où un groupe de scientifiques américains a collaboré avec des chercheurs russes du célèbre Institut commun de recherche nucléaire (JINR), dirigé par le scientifique russe Yuri Oganessian.
Dans une période de dix ans depuis la première synthèse, seuls quatre atomes d'oganestone ont été synthétisés, en raison de la rareté et de la difficulté des paramètres de réaction. Le quatrième et dernier atome, cependant, a présenté une découverte incroyable.
Les scientifiques essayaient de synthétiser l'élément 117 par la réaction de 48Ca avec le 249Bk, cependant, il a été remarqué que 28% de la cible de berkelium a subi une désintégration β, se convertissant en 249Cf et donc élément générateur 118. Il est à noter que le nom de l'élément 118 rend hommage au scientifique russe Yuri Oganessian, un hommage qui pour les chimistes vivants n'a eu lieu que deux fois dans l'histoire de la chimie, le premier étant à Glenn Seaborg, avec le seborgium.
Exercices résolus sur oganesson
question 1
L'Oganessone, élément de numéro atomique 118 et de symbole Og, a été placé dans la septième période du tableau périodique, dans le groupe des gaz nobles. En conséquence, beaucoup a été spéculé sur la question de savoir si un tel élément présenterait une grande stabilité, une caractéristique connue des autres éléments de ce groupe. L'attribution d'Og dans le groupe 18 était due à:
A) cet élément est très stable.
B) cet élément a huit électrons dans sa couche de valence.
C) cet élément est manifestement un gaz à température ambiante.
D) cet élément a les mêmes propriétés chimiques que les autres gaz nobles.
E) cet élément a une énergie d'ionisation élevée.
Résolution:
Variante B
L'attribution de l'Og a lieu uniquement et exclusivement en raison de son distribution électronique. Le fait qu'il ait huit électrons dans couche de valence, 7s2 7p6, le place dans cette position. Les études avec cet élément sont encore préliminaires, mais il est déjà supposé, en raison de résultats mathématiques, que l'Og n'est pas un gaz à température ambiante, par exemple. Un autre point à souligner est que Og n'est pas du tout stable, n'existant même pas dans la nature.
question 2
La grande difficulté à produire l'élément 118 génère l'idée que les scientifiques étaient sur une véritable odyssée pour pouvoir le détecter. Pas étonnant, après dix ans de sa première synthèse, oganesson n'a été synthétisé que trois autres fois. Et jusqu'à présent, un seul isotope est connu, le 294oh Combien de neutrons l'isotope connu d'oganesson possède-t-il ?
A) 294.
B) 118.
C) 176.
D) 412.
E) 166.
Résolution:
Variante C
Le nombre de neutrons de Og peut être calculé comme suit :
A = Z + n
A est le nombre de Pâtes atomique, Z est le nombre de protons (ou numéro atomique) et n est le nombre de neutrons. En substituant les valeurs, nous avons :
294 = 118 + n
n = 294 - 118
n = 176
Par Stefano Araújo Novais
Professeur de chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/oganessonio-og.htm