LA hassium, avec le symbole Hs et numéro atomique 108, est l'un des éléments connus sous le nom de transactinides. Comme tous les éléments de ce groupe, il ne se trouve pas dans la nature, étant synthétique, en plus d'être radioactif et instable. Sa synthèse est attribuée aux laboratoires allemands du Centre Helmholtz de recherche sur les ions lourds (GSI), dans la ville de de Darmstadium, en Allemagne, et son nom a été donné en l'honneur de l'état allemand de Hesse, situé dans la région centrale de la parents.
L'Hassium est l'élément le plus lourd dont les propriétés ont été analysées, grâce à des expériences menées par le GSI lui-même. Les résultats étaient importants pour confirmer la position de Hs dans le Tableau périodique, car la similitude entre cet élément et l'osmium et le ruthénium, éléments plus légers du groupe 8, a été perçue.
A lire aussi :Bohrium - l'élément chimique synthétique nommé d'après Niels Bohr
Résumé Hassium
C'est un élément chimique synthétique situé dans le groupe 8 du tableau périodique.
Il a été synthétisé par la Gesellschaft für Schwerionenforschung (GSI) à Darmstadium, en Allemagne.
C'est un élément radioactif et instable.
Les données théoriques et expérimentales confirment que ses propriétés ressemblent aux éléments les plus légers de son groupe.
En tant que transactinide, il ne peut pas être produit à grande échelle, si ce n'est au rythme de quelques atomes.
Ne vous arrêtez pas maintenant... Y'en a plus après la pub ;)
Propriétés hassium
Symbole: hs
Numéro atomique: 108
Masse atomique: 277 cu.
Configuration électronique: [Rn] 7s2 5f14 6d6
Isotope le plus stable: 269Hs (demi-vie de 14 secondes)
Série chimique : groupe 8; transactinides; éléments super lourds.
Fonctionnalités Hassium
Hassium est un élément synthétique et le plus lourd du groupe 8. Il est considéré comme un transactinide, précisément parce qu'il apparaît dans le tableau périodique après la série des actinides. Comme tous les transactinides, l'hassium est un élément radioactif et instable.
Cela signifie que ses isotopes atteignent peu de temps de demi-vie (le temps nécessaire pour que la masse de l'espèce atomique diminue de moitié). Actuellement, sept isotopes du hassium sont connus, dont la masse varie de 264 a.m.u. à 270 a.m.u. Parmi tous, le plus stable est l'isotope 269Hs, avec une demi-vie de 14 secondes.
Bien que la courte demi-vie rende difficile l'étude des propriétés chimiques des transactinides, le hassium a eu un peu plus de chance à cet égard. En juin 2001, il a été annoncé qu'il était devenu l'élément le plus lourd dont les propriétés ont été analysées.
Une équipe a réussi, dans la ville de Darmstádio, en Allemagne, à produire environ six atomes de Hs avec une demi-vie d'environ 10 secondes. Bien que cela semble peu, cela a suffi à confirmer que l'oxyde de hassium, HsO4, présente de fortes similitudes avec les oxydes des éléments plus légers du groupe 8, RuO4 et OsO4, C'est le ruthénium C'est le osmium.
Voir aussi: Seaborgium - un autre élément chimique synthétique aux propriétés radioactives et à courte demi-vie
Obtenir Hassium
Les transactinides ont en commun la difficulté d'être produits. En général, un équipement de pointe est requis, tel que accélérateurs de particules. Dans ceux-ci, les espèces ioniques entrent en collision avec des éléments de haute masse atomique pour former les éléments superlourds (dans lesquels Hs est inclus).
Dans le cas de l'hassium, les études qui ont confirmé sa position dans le groupe 8 du tableau périodique concernaient sa production par bombardement de magnésium-26, avec le curium-248 comme cible.
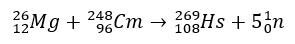
Les expériences impliquant ces éléments sont coûteuses et, par conséquent, il est courant que des études théoriques soient menées, précisément pour calculer et prédire les propriétés chimiques. La courte demi-vie est un autre facteur de complication.
Les techniques expérimentales de séparation et détection doit être très rapide pour produire des résultats crédibles. Enfin, le rendement de réaction de ces éléments est très faible, de l'ordre de quelques unités atomiques.
Précautions avec Hassium
Hs n'est pas produit à grande échelle, et donc sa manipulation ne comporte pas de risques. De plus, il est obtenu dans des centres de recherche avec des environnements hautement contrôlés.
histoire de hassium

Les transactinides ont été les protagonistes d'une dispute scientifique en raison de la Guerre froide, un Guerre des transferts, un nom inventé en référence aux conflits qui impliquaient la production et la reconnaissance des éléments après le fermium (Fm, Z = 100). Dans cette course, les laboratoires ont été impliqués :
Institut commun de recherche nucléaire, dans la ville de Doubna, Russie ;
Lawrence Berkeley National Laboratory à Berkeley, Californie ;
Gesellschaft für Schwerionenforschung (GSI, mieux traduit par Centre Helmholtz de recherche sur les ions lourds) à Darmstadium, en Allemagne.
Dans le cas de l'élément 108, les groupes GSI et Dubna étaient impliqués. Cependant, bien que les scientifiques de Dubna (dirigés par Yuri Oganessian) aient signalé pour la première fois la présence de l'élément 108, ceux du groupe allemand en ont pris le crédit, car le GSI a présenté des résultats plus probants, tandis que dans une expérience, il a réussi à produire trois atomes de l'isotope 265, tandis que dans une autre, il a produit un atome de l'isotope 264.
Ces isotopes ont été produits à l'aide de l'accélérateur linéaire universel (Unilac, mieux traduit par accélérateur linéaire universel), avec bombardement du 208Pb par 58Foi. En 1997, l'Union internationale de chimie pure et appliquée (IUPAC) a reconnu l'élément 108, avec le symbole Hs, comme Hassium en l'honneur de l'état allemand de Hesse.
Exercices résolus sur hassium
question 1
Hassium, symbole Hs, est considéré comme l'élément le plus lourd dont les propriétés ont été étudiées expérimentalement. À l'époque, les chercheurs ont pu déterminer les propriétés du tétroxyde de hasium, HsO4. Chez cette espèce, Hs a le même NOx que les éléments plus légers de son groupe, l'osmium (Os) et le ruthénium (Ru). Le nombre d'oxydation de Hs dans le tétroxyde de hassium est égal à :
a) 0
B) +2
C) +4
D) +6
E) +8
Résolution:
Variante E
LA oxygène, quand dans un oxyde, acquiert une charge égale à -2. Alors le NOx de Hs, que nous appellerons x, peut être calculé comme suit :
X + 4(-2) = 0
x - 8 = 0
x = +8
question 2
L'isotope le plus stable du hassium, Hs, a une demi-vie de seulement 14 secondes. Cela signifie:
A) en 14 secondes, la masse de l'isotope de Hs aura doublé.
B) après 14 secondes, la masse de l'isotope Hs sera inférieure à la moitié de la masse initiale.
C) en un peu moins d'une minute, la masse de l'isotope Hs sera de 1/16 de sa masse initiale.
D) en une minute, la masse de l'isotope Hs sera exactement la moitié de sa masse initiale.
E) en 14 secondes, la masse de l'isotope Hs sera divisée par 4.
Résolution:
Variante C
La demi-vie indique le temps nécessaire pour que la quantité d'espèces atomiques diminue de moitié. Cela signifie que toutes les 14 secondes, la quantité de Hs diminue de moitié. En observant cette demi-vie, il est clair qu'avec 56 secondes, quatre demi-vies ont déjà été atteintes, provoquant la division de la masse de Hs par 24, soit 16.
Par Stefano Araújo Novais
Professeur de chimie