LA rutherfordium est un élément synthétique de numéro atomique 104, appartenant au groupe 4 de la Tableau périodique, étant le premier membre de la série des transactinides. Sa première détection date de 1964, dans les célèbres laboratoires de la ville de Dubna. Comme d'autres transactinides, le nom officiel de l'élément 104 a été impliqué dans un conflit entre les Soviétiques et les Américains, dans une pièce de la guerre froide de l'histoire de la chimie.
le rutherfordium n'a pas d'applications pratiques, étant donné que son isotope le plus stable a environ deux heures et demie de demi vie. Cependant, des études dans des systèmes et des solutions gazeuses prouvent sa similitude chimique avec les autres éléments du groupe 4, tels que le zirconium et hafnium.
A lire aussi: Seaborgium - élément synthétique nommé d'après le scientifique Glenn Seaborg
Résumé de Rutherfordium
- C'est un élément chimique synthétique situé dans le groupe 4 du tableau périodique.
- Il a été synthétisé pour la première fois en 1964 à l'Institut commun de recherche nucléaire de Dubna, en Russie.
- C'est un élément radioactifgrand-mère.
- Comme les autres transactinides, le rutherfordium souffre d'une faible stabilité et il est difficile de synthétiser des échantillons considérables pour les études.
- Son nom n'a été officialisé qu'en 1997, après plusieurs années de dispute entre les Américains et les Soviétiques.
Propriétés du Rutherfordium
- symbole: Rf
- numéro atomique: 104
- masse atomique: 267 u.m.
- Configuration électronique: [Rn] 7s2 5f14 6d2
- isotope le plus stable: 267Rf (2,5 ± 1,5 heures de demi-vie)
- série chimique: groupe 4, transactinides, éléments superlourds
Caractéristiques du Rutherfordium
Comme tous les transactinides, c'est-à-dire les éléments juste après laurence (Lr), le rutherfordium est un élément radioactif. Son isotope le plus stable a été détecté en 2004 et sa demi-vie (le temps nécessaire pour la quantité de radio-isotope tomber de moitié) est de deux heures et demie, avec une marge d'erreur d'une heure et demie, plus ou moins.
La grande difficulté d'établir les caractéristiques chimiques du rutherfordium et d'autres transactinides est, en général, le fait qu'il existe un faible taux de production, soit en quantité, soit en rapidité. Dans ces éléments, par exemple, il est très courant de n'évaluer chimiquement qu'un seul atome, ce qui nécessite en quelque sorte des adaptations en termes de calculs, puisque la plupart des équations sont établies pour des systèmes à plus d'un atome. De plus, souvent le les isotopes ont des demi-vies très courtes, ce qui rend difficile, voire impossible, des études plus approfondies.
Dans le cas précis de Rf, les scientifiques sont déjà parvenus à prouver que son comportement en phase liquide est similaire à celui d'autres éléments. groupe plus léger 4, zirconium et hafnium, comme dans la formation de fluorures en solution avec extraction ultérieure dans des résines échangeuses d'ions. Ce comportement a contribué à solidifier la présence de rutherfordium dans le groupe 4 du tableau périodique.
Lire aussi: Nouveaux éléments chimiques — les quatre éléments manquants dans la 7e période
Obtention du Rutherfordium
Les transactinides ont besoin d'une grande infrastructure pour leur production. Tout sont synthétisés avec accélérateurs de particules, dans lequel des espèces ioniques entrent en collision avec des éléments lourds. La détection de ces éléments n'est pas non plus simple et directe.
Une fois formé, l'élément radioactif, de par sa nature, commence à se désintégrer et à émettre des émissions, telles que des particules alpha et bêta. Il est souvent nécessaire d'évaluer désintégration radioactive de l'atome formé ou encore identifier les espèces atomiques pouvant résulter de ces réactions nucléaires, comme dans un puzzle.
Ajoutez à cela le fait que les demi-vies des isotopes transactinides sont souvent courtes, de l'ordre de secondes, ne permettant d'obtenir qu'une quantité de l'ordre de quelques atomes ou même un seul atome.
Dans le cas de Rf, la première synthèse rapportée pour cet élément impliquait la collision d'isotopes du plutonium, Pu, avec des ions de l'isotope 22 du néon, Hein.
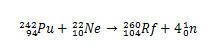
Cependant, d'autres isotopes du rutherfordium peuvent être produits en modifiant les espèces qui entreront en collision. Par exemple, l'isotope 261 peut être produit par la réaction entre l'oxygène-18 et le curium-248, produisant cinq neutrons.
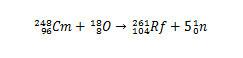
Découvrez-le sur notre podcast: Comment fonctionne un accélérateur de particules ?
Précautions avec le Rutherfordium
Le rutherfordium ne pouvant même pas être produit à grande échelle, les risques associés à cet élément sont liés à la les effets de radiation. Cependant, dans un laboratoire contrôlé, ces risques sont anticipés et donc minimisés.
Histoire du Rutherfordium

Tous les transactinides ont été impliqués dans une course pour leur découverte dans les années 1960 et 1970. Cet épisode est rapporté comme le Guerre des transferts, un morceau de la Guerre froide dans l'histoire de la chimie. Bien qu'il soit appelé ainsi, ce qui suggère que les différends se sont produits sur des éléments après le fermium, un élément numéro atomique 100, les éléments directement impliqués étaient de 104 à 109, le nouveau transactinides.
Dans le cas du rutherfordium, le différend a commencé en 1964., lorsque des chercheurs soviétiques de l'Institut commun de recherche nucléaire de la ville de Dubna La Russie a signalé la découverte de l'isotope 260 de l'élément 104 en bombardant du plutonium-242 avec des ions néon-22. Mais les chercheurs de Dubna n'ont présenté qu'un seul élément de preuve, à savoir la détection d'un isotope qui s'est décomposé spontanément, sans identifier clairement sa masse et son temps de demi vie. En conséquence, la découverte a été considérée avec suspicion.
Cinq ans plus tard, en 1969, une équipe de scientifiques américains du Lawrence Berkeley National Laboratory à Berkeley, en Californie, dirigée par Albert Ghiorso, a déclaré avoir fourni des preuves suffisantes pour la découverte de l'isotope 257 de l'élément 104 en faisant entrer en collision du californium-249 avec carbone-12. Les mêmes scientifiques ont ensuite pu produire l'isotope 259 de l'élément 104. En 1973, des scientifiques du laboratoire national d'Oak Ridge ont confirmé de manière indépendante la numéro atomique 104 pour l'isotope de masse 257 produit à Berkeley.
Les années suivantes furent une grande dispute entre les scientifiques des deux pays, jusqu'à ce qu'en 1985, le de chimie pure et appliquée (IUPAC) et l'Union internationale de physique pure et appliquée (IUAP) former un commission mixte de neuf scientifiques, appelée Transfers Working Group (Groupe de Travail Transfermium ou TWG). Le TWG a été créé pour décider qui était réellement responsable des découvertes d'éléments allant de 101 à 112.
Même ainsi, les décisions du TWG n'étaient pas toujours sans appel. Dans le cas de l'élément 104, le groupe de travail a décidé que le Le crédit devrait être partagé entre les scientifiques soviétiques et américains, quelque chose que les scientifiques de Berkeley n'aimaient pas du tout.
En 1991, Ghiorso et Seaborg, de l'équipe de Berkeley, ont même affirmé que l'identification de l'élément 104 par les scientifiques de Dubna était clairement faux et, à un moment donné, a nié la validité des conclusions du TWG, les considérant comme un mauvais service à la communauté scientifique.
Pas étonnant, dans Au début des années 1990, les noms des nouveaux éléments ne faisaient toujours pas consensus.. Il y a eu alors des négociations impliquant des scientifiques allemands, russes et américains, qui se sont avérées frustrées. Là, en 1992, le laboratoire allemand Gesellschaft für Schwerionenforschung (GSI) a proposé des noms pour les éléments 102 à 109, mettant le meitnerium pour l'élément 104.
Même ainsi, la liste, malgré ses éloges, n'a pas été acceptée par les scientifiques impliqués. La décision pourrait être prise en 1994, lors de la conférence de la Iupac Inorganic Compound Nomenclature Commission (CNIC). Dans celui-ci, le nom dubnium a été choisi pour l'élément 104, cependant, l'American Chemical Society a adopté, la même année, le nom rutherfordium pour l'élément 104. élément 104, dans un moment de discrédit de la part des américains, venus remettre en cause l'autorité de l'IUPAC pour formaliser de nouvelles noms.
seulement en 1997, à la conférence générale de l'IUPAC à Genève, est que l'élément 104 a finalement été officialisé sous le nom de rutherfordium, après que l'ACS ait cédé la place à la nomenclature d'autres éléments voisins.
Exercices résolus sur rutherfordium
question 1
Le rutherfordium est un élément synthétique et l'une des principales difficultés pour l'étudier est le fait qu'il n'est pas possible d'en synthétiser de grandes quantités.
Parmi les facteurs possibles qui contribuent à cette difficulté, nous pouvons indiquer :
(A) Le rutherfordium a des isotopes à longue demi-vie de l'ordre de millions d'années.
(B) Rutherfordium se désintègre spontanément et très rapidement, empêchant la détection de ses quantités macroscopiques.
(C) Il n'existe pas de technologies capables de synthétiser le rutherfordium, leurs données étant strictement théoriques et sans fondement scientifique.
(D) Les lois de la chimie stipulent qu'il est impossible de synthétiser des éléments dont le numéro atomique dépasse celui de lawrence, 103.
(E) Lors de la synthèse du rutherfordium, les éléments plus légers de son groupe sont chimiquement prioritaires.
Répondre: la lettre B
Les éléments transactinides, tels que Rf, sont radioactifs et se désintègrent spontanément à grande vitesse, car leur demi-vie est courte. Ainsi, à la fin de l'expérience, il reste peu d'atomes de l'espèce synthétique.
question 2
En 1964, des chercheurs de Dubna ont affirmé avoir synthétisé l'isotope 260 du rutherfordium (Z = 104). Dans le cas de cet isotope, quel est le nombre de neutrons ?
(A) 104
(B) 260
(C) 151
(D) 156
(E) 161
Répondre: lettre D
Le nombre de neutrons (n) peut être calculé, en utilisant le nombre de masse (A) et le numéro atomique (Z), par l'équation suivante :
A = Z + n
En remplaçant, nous avons :
260 = 104 + n
n = 260 - 104
n = 156
crédits images
[1] Abbas rose / obturateur
Par Stefano Araújo Novais
Professeur de chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/rutherfordio-rf.htm
