Électrolyse c'est un processus non spontané, c'est-à-dire qui ne se produit pas naturellement, dans lequel des substances sont formées au moyen d'une décharge électrique dans des composés fondus ou dissous dans l'eau. Dans ce processus, un courant électrique atteint un récipient en verre (réservoir électrolytique) qui a deux électrodes inertes (qui ne souffrent pas ou oxydation ni réduction) formé de graphite ou de platine. Ces électrodes sont connectées à une source électrique (généralement un tambours) et trempés dans un sel ou une base fondus ou dissous dans l'eau. Tout comme le la batterie, l'électrolyse a une cathode (où se produit la réduction) et une anode (où se produit l'oxydation).
Résumé
L'électrolyse est un processus non spontané;
Des substances simples ou composites peuvent être formées ;
Il peut se produire avec un soluté fondu (électrolyse ignée);
Elle peut se produire avec un soluté dissous dans l'eau (électrolyse aqueuse) ;
Un cation subit toujours une réduction à la cathode ;
Un anion subit toujours une oxydation à l'anode.
Voir aussi :Obtention de l'aluminium par électrolyse

Types d'électrolyse
C'est une électrolyse qui se produit lorsqu'une décharge électrique est effectuée sur un composé ionique fondu. Le composé ionique est un composé formé par une liaison ionique, telle qu'un sel ou un base inorganique. Lorsque nous parlons de composé fondu, à son tour, nous nous référons au composé qui passe d'un état solide à un état liquide.
- Exemple d'électrolyse ignée
Lorsque nous effectuons la fusion du chlorure de potassium (KCl), ce sel subit le processus de dissociation, libérant le cation potassium (K+) et l'anion iodure (l-).

Équation de dissociation pour le chlorure de potassium
Lorsque le courant électrique atteint la cellule électrolytique avec ces ions, le cation potassium est réduit, formant du potassium métallique (K), et l'anion iodure est oxydé, formant de l'iode solide (I2).
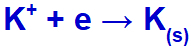
Équation de formation de potassium solide
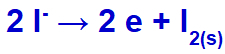
Équation de formation d'iode solide
C'est une électrolyse qui se produit lorsque la décharge électrique s'effectue sur une solution aqueuse (a de l'eau) formée d'un sel ou d'une base minérale.
- Exemple d'électrolyse aqueuse
Lorsque nous dissolvons du chlorure de sodium dans l'eau, il se dissocie et l'eau subit une ionisation :

Equations d'ionisation de l'eau et de dissociation du chlorure de sodium
Comme cation sodium (Na+) appartient à la famille IA, le cation hydronium (H+) traverse la décharge et subit une réduction, formant de l'hydrogène gazeux (H2).
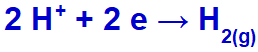
Équation de formation d'hydrogène gazeux
Comme chlorure (Cl-) n'est pas oxygéné (ne contient pas d'oxygène) et n'est pas fluoré (F-), il est rejeté, s'oxydant et formant du chlore gazeux (Cl2).

Équation de formation de chlore gazeux
Décharge ionique sélective
Lors d'un processus d'électrolyse en milieu aqueux (solution formée d'eau et d'un soluté), on aura toujours deux cations: l'hydronium, de l'eau, et tout autre, de la dissociation du sel (un exemple de soluté). Nous aurons également deux anions: l'hydroxyle, qui vient de l'eau, et un autre, qui vient du sel.

Ions provenant de l'ionisation de l'eau et de la dissociation du sel
- Décharge sélective pour les cations et les anions
Si le cation du soluté appartient à la famille IA, IIA ou IIIA, l'hydronium (H+) va être réduit;
Si le cation provenant du soluté n'appartient pas aux familles mentionnées ci-dessus, il subira la réduction.
Si l'anion du soluté a de l'oxygène dans sa composition ou est un fluorure (F-), l'hydroxyde (OH-) subira une oxydation;
Si l'anion du soluté n'a pas les caractéristiques ci-dessus, il subira une oxydation.
On sait que l'eau a la capacité de s'auto-ioniser, produisant des ions hydronium (H+) et l'hydroxyde (OH-), mais cette ionisation est assez limitée. Ce fait est prouvé par l'inefficacité de l'eau pure à conduire le courant électrique.
Tel que électrolyse implique une décharge électrique, pour effectuer l'électrolyse de l'eau, il est nécessaire de dissoudre un soluté, le qui favorise le rejet sélectif d'hydronium et d'hydroxyde (comme vu dans la rubrique sur les rejets sélectif).
Si on ajoute du sulfate de sodium (Na2SEUL4), par exemple, nous aurons les cations sodium au milieu (Na+) et l'hydronium (H+), ainsi que les anions hydroxyde (OH-) et sulfate (SO4-2). Ainsi, lorsque le courant électrique arrive dans la cuve électrolytique :
l'hydronium sera rejeté, réducteur, car le sodium appartient à la famille IA ;
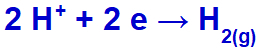
Équation de formation d'hydrogène gazeux
l'hydroxyde va subir une décharge, oxydante, car le sulfate a de l'oxygène dans sa composition.
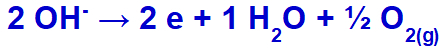
Équation de formation d'oxygène gazeux
Comme les deux ions (cation et anion) provenant de l'eau se sont déchargés, on dit que l'électrolyse de l'eau a eu lieu.
Voir aussi: Aspects quantitatifs de l'électrolyse
Production de substances simples telles que l'hydrogène gazeux (H2), l'oxygène gazeux (O2) etc.;
Production de substances composites telles que l'hydroxyde de sodium (NaOH), l'acide sulfurique (H2SEUL4) etc;
Revêtement d'une pièce avec un métal particulier, tel que le cuivre (cuivre) et l'or (placage à l'or);
Utilisez-le pour retirer un certain métal de votre minerai.
Exercices résolus sur l'électrolyse
Exemple 1 - (Vunesp) Une solution aqueuse de CuCℓ2 est soumis à une électrolyse, à l'aide d'électrodes de platine. L'énoncé correct est :
a) La réduction des ions Cu se produit à la cathode2+.
b) L'oxydation des ions Cu se produit à l'anode2+.
c) Du chlore gazeux se forme à la cathode.
d) Une partie de l'anode en platine se dissout, formant du Pt2+.
e) Les produits de cette électrolyse seraient différents si l'électrolyse de CuCl2 étaient fougueux (fusion).
a) Exact. Quand CuCl2 est dissous dans l'eau, on a les cations hydronium (H+) et le cuivre II (Cu+2). Le cation cuivre II n'appartenant pas aux familles IA, IIA et IIIA, il est réduit.
b) Faux, car l'anion chlorure (Cl) est oxydé à l'anode-), qui n'a pas d'oxygène dans sa composition et n'est pas du fluorure (F-).
c) Faux, car la réduction du cation cuivre II se produit à la cathode, il y a donc formation du cuivre métallique.
d) Faux, comme les électrodes de platine ou de graphite en électrolyse ne conduisent que l'électricité, elles ne participent pas au processus.
e) Faux, car l'électrolyse ignée du chlorure de cuivre II (CuCl2) présenterait exactement les mêmes produits que l'aqueux, car les ions présents seraient le cuivre II (Cu+2) et le chlorure (Cl-1).
Exemple 2- (UFRN) Considérez les systèmes suivants :
JE. Chlorure de sodium fondu;
II. Solution aqueuse de chlorure de sodium;
III. hydroxyde de sodium fondu;
IV. Solution aqueuse d'hydroxyde de sodium.
Ceux qui peuvent fournir du sodium, lorsqu'ils sont soumis à l'électrolyse, sont :
a) seulement I et II.
b) seulement I et III.
c) seulement II et IV.
d) seulement III et IV.
e) I, II, III et IV.
Les systèmes qui fournissent du sodium métallique comme produit à la cathode sont I et III.
I- Le seul cation présent dans le milieu est le cation sodium, il est donc le seul à pouvoir se réduire en formant du sodium métallique.
II- Ce système ne fournit pas sodium métallique car le chlorure de sodium a été dissous dans l'eau, donc au milieu nous avons la présence de cations sodium (Na+) et l'hydronium (H+) - c'est lui qui subit la réduction, car le sodium appartient à la famille IA.
III- Le seul cation présent dans le milieu est le cation sodium (car le matériau a subi une fusion), donc, seul il subit une réduction, formant du sodium métallique ;
IV- Ce système ne fournit pas sodium métallique car l'hydroxyde de sodium a été dissous dans l'eau, donc au milieu nous avons la présence de cations sodium (Na+) et l'hydronium (H+) - c'est lui qui subit la réduction, car le sodium appartient à la famille IA.
Par moi Diogo Lopes Dias


