LES distillation est une méthode de séparation de mélanges homogènes, c'est-à-dire lorsque les composants sont en une seule phase.
Il existe deux types de distillation. La distillation simple est utilisée dans la séparation solide-liquide et la distillation fractionnée dans un mélange de liquides miscibles entre eux.
Pour pouvoir isoler un composant particulier d'un mélange, il est nécessaire de modifier une variable. Dans le cas de la distillation, la séparation se produit en changeant la température de sorte que le composant d'intérêt change d'état physique.
La propriété des substances utilisées dans ce processus est la point d'ébullition, c'est-à-dire la température à laquelle se produit le passage du liquide au gaz.
processus de distillation
Le processus de distillation consiste à fournir de la chaleur à un mélange jusqu'à ce que le point d'ébullition du composant d'intérêt soit atteint et qu'il passe à l'état gazeux, se séparant des autres.
Après cela, le gaz traverse une colonne de refroidissement, où la chaleur sera retirée de la substance jusqu'à ce qu'elle atteigne son point de fusion et retourne ainsi à l'état liquide. Ce matériau est dirigé vers un autre conteneur.
distillation simple
Pour séparer un mélange homogène de solide dissous dans un liquide une distillation simple est utilisée.
Dans l'image ci-dessous, nous pouvons voir l'équipement de base pour le processus de séparation.

Sont-ils:
- Ballon de distillation (1), qui contient le mélange ;
- Couverture chauffante (2), qui fournit de la chaleur au mélange ;
- Thermomètre (3), pour surveiller le changement de température ;
- Condenseur (4), pour refroidir le composant évaporé et
- Bécher (5), pour recueillir le composant séparé à l'état liquide.
Ce procédé peut être utilisé, par exemple, pour séparer le chlorure de sodium (NaCl), appelé sel de table, et l'eau. Le sel a un point d'ébullition de 1465 °C et se dissout dans l'eau pour former un mélange homogène.
Comme l'eau a un point d'ébullition de 100 ºC, elle passe facilement à l'état gazeux et se sépare du mélange, tandis que le sel cristallise et reste à l'état solide dans le récipient.
La vapeur d'eau sort par le haut du ballon de distillation et traverse un condenseur. De l'eau froide ou froide circule sur les parois de cet équipement. L'échange de chaleur entre les fluides amène le composant séparé du mélange à perdre de la chaleur et à revenir à un état liquide pour être collecté dans un autre récipient. Ce liquide est appelé distillat.
distillation fractionnée
Pour séparer un mélange homogène de liquides miscibles entre eux et avec une grande différence entre les températures d'ébullition, la distillation fractionnée est utilisée.
Cette méthode est fractionnée car les composants sont séparés du mélange dans ordre croissant de point d'ébullition, c'est-à-dire en commençant par la plus basse jusqu'à celle qui nécessite la température la plus élevée pour changer de phase.
Dans l'image ci-dessous, il y a l'équipement utilisé pour effectuer la méthode.
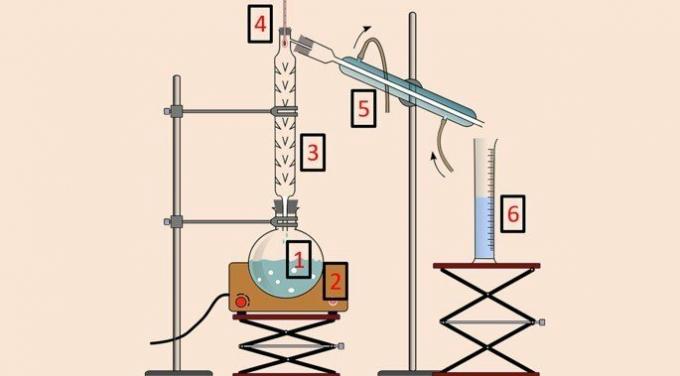
Comme pour la distillation simple, on utilise un ballon de distillation (1), une couverture chauffante (2), un thermomètre (4), un condenseur (5) et un bécher (6). Cependant, le colonne de distillation ou de fractionnement (3) est l'équipement qui permet la séparation en fonction de la température.
La colonne de distillation a une série d'obstacles à l'intérieur pour empêcher tous les composants du mélange de se volatiliser en même temps.
Ce procédé est largement utilisé pour séparer des fractions de pétrole, qui est un mélange d'hydrocarbures. Certains des composants pétroliers et leurs points d'ébullition (PE) respectifs sont: le butane (PE 20 ºC), l'essence (PE 150 ºC) et le kérosène (PE 300 ºC).
Par distillation fractionnée, le butane est le premier composant séparé, car il a le point d'ébullition le plus bas, puis l'essence, avec un point d'ébullition intermédiaire, et enfin le kérosène.
Applications de distillation
La distillation est largement utilisée dans les industries, car de nombreux mélanges subissent ce processus. Les spiritueux tels que le whisky, le brandy et la vodka sont fabriqués selon cette méthode.
L'industrie pétrochimique utilise la distillation fractionnée pour raffiner le pétrole. Les tours de distillation sont de grandes structures conçues pour séparer les fractions de ce combustible fossile.

Exercices de distillation
question 1
La distillation est une méthode de séparation basée sur les propriétés.
la chimie
b) Physique
c) Biologique
d) Généralités sur l'affaire
Alternative: b) Physique.
Le point d'ébullition est une propriété physique spécifique de la matière, car il est inhérent à une substance donnée. C'est la température à laquelle un matériau passe de l'état liquide à l'état gazeux, c'est-à-dire qu'il subit une évaporation.
question 2
Ce sont des exemples de mélanges séparés par distillation, SAUF
a) eau + acétone
b) la saumure
c) eau + huile
d) eau de mer
Alternative correcte: c) eau + huile.
L'eau et l'huile sont des substances non miscibles. Dans ce cas, la méthode de décantation est utilisée pour séparer les composants du mélange. Cette méthode est basée sur la différence de densité.
La saumure (eau + sel) et l'eau de mer, qui contient également des sels dissous, sont séparées par simple distillation. Pour l'eau et l'acétone, la distillation fractionnée est utilisée.
question 3
(UFRGS) Un système hétérogène biphasique est formé de trois liquides différents A, B et C. Il est connu que:
A et B sont miscibles entre eux ;
C est non miscible avec A et avec B ;
A est plus volatile que B.
Sur la base de ces informations, les méthodes les plus appropriées pour séparer les trois liquides sont :
a) centrifugation et décantation.
b) décantation et fusion fractionnée.
c) filtration et centrifugation.
d) filtration et distillation fractionnée.
e) décantation et distillation fractionnée.
Alternative correcte: e) décantation et distillation fractionnée.
Le système hétérogène de la question comporte deux phases :
Phase 1: liquides A et B, miscibles entre eux
Phase 2: liquide C, non miscible avec les autres composants
Par conséquent, en raison de la différence de densité, la phase 1 est séparée de la phase 2 en utilisant la méthode de décantation. En raison de la différence de température d'ébullition, puisque A est plus volatil que B, c'est-à-dire qu'il a tendance à passer facilement à l'état gazeux, une distillation fractionnée est utilisée.
Acquérir plus de connaissances avec le contenu :
- Distillation simple et fractionnée
- Séparation des mélanges
- Exercices sur la séparation des mélanges


