Plus la température est élevée, plus la vitesse de réaction est grande.
Cela peut être facilement vu dans de nombreuses situations de notre vie quotidienne, comme dans les exemples suivants :
- Lorsque nous voulons ralentir la réaction de décomposition d'un aliment, nous abaissons la température en le plaçant au réfrigérateur ;

- Si nous voulons accélérer la réaction de cuisson des aliments, il suffit de les mettre dans une marmite. pression qui, avec l'augmentation de la pression, augmente également la température d'ébullition de l'eau liquide dans laquelle le la nourriture est;

- Les incendies, en général, sont généralement dévastateurs car la température de l'environnement augmente, ce qui provoque une augmentation de la vitesse de la réaction de combustion ;
- Pour ralentir les processus chimiques métaboliques, en diminuant les risques de lésions cérébrales dues à manque d'oxygène, certaines chirurgies sont effectuées en abaissant la température corporelle du patient, en restant à environ 15°C ;
- Si on met un comprimé effervescent dans un verre d'eau chaude et un autre dans un verre d'eau froide, le premier se dissoudra beaucoup plus vite.
Mais qu'est-ce qui explique l'influence directement proportionnelle de la température sur la vitesse de réaction ?
C'est parce que, comme expliqué dans le texte "Conditions de survenue de réactions chimiques”, pour qu'une réaction se produise, il est nécessaire de satisfaire certaines conditions, telles que que les particules ils doivent entrer en collision efficacement et avec l'énergie minimale requise, qui est appelée énergie d'activation.
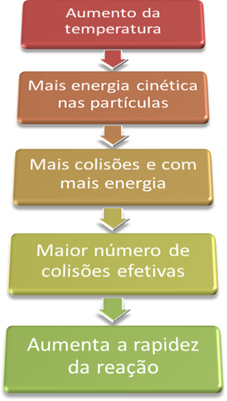
Ainsi, lorsque nous augmentons la température du système, nous augmentons également l'agitation des particules en réaction et leur fournissons plus d'énergie cinétique. Avec cela, plus de collisions se produiront et avec plus d'énergie, augmentant la quantité de particules qui réagiront et, par conséquent, augmentant la vitesse de réaction.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm


