Polymérisation est le nom du processus chimique qui aboutit à la formation de macromolécules (grosses molécules) appelées polymères, grâce à la combinaison de molécules plus petites, les monomères.
la réaction de polymérisation il est très courant dans la nature, comme on peut le voir dans les glucides (comme l'amidon) et les protéines (comme la caséine dans le lait). Il se produit également de manière synthétique, puisque la grande majorité des polymères utilisés par les êtres humains dans leur vie quotidienne sont fabriqués artificiellement.
Le premier polymère produit à partir de polymérisation synthétique était la bakélite, en 1909, par le chimiste belge Leo Hendrik Baekeland.
En général, pour qu'un monomère soit combiné avec un autre (qu'ils soient identiques ou différents) dans une réaction de polymérisation, il faut l'existence de valence libre (liaison chimique à réaliser) dans les deux monomères.
Ces valences résultent de la rupture des liaisons, grâce à l'utilisation de catalyseurs (tels que le nickel), conditions extérieures telles que la lumière et la chaleur, ou par le phénomène de résonance dans la structure (déplacement des électrons).
Dans la formation du polypropylène (polymère PP), par exemple, utilisé dans les ustensiles ménagers et les jouets, le lien pi (π) dans chaque molécule se décompose comme suit :
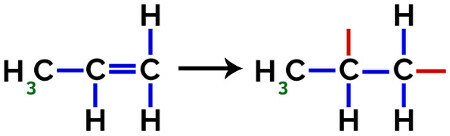
Rupture de la liaison pi dans le propylène
Ainsi, chaque monomère de propylène peut se lier à deux autres monomères de propylène et former le polymère PP ou polypropylène (le préfixe poly indique plusieurs unités monomères). La façon la plus fréquente de représenter un polymère a le monomère entre parenthèses et, à l'extérieur, la lettre n, qui indique plusieurs monomères, comme on peut le voir dans le cas du polymère PP :
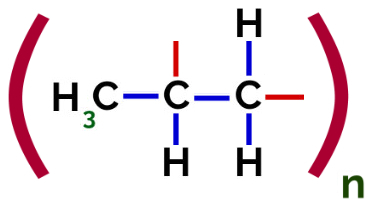
Représentation du polymère PP
la réaction de polymérisation peut se faire de différentes manières, comme nous le verrons ci-dessous :
a) Réaction de polymérisation par addition
Dans ce polymérisation, il y a toujours une rupture d'une liaison pi dans le monomère, ce qui fait apparaître deux valences libres dans la structure, comme dans la formation du polyéthylène, polymère largement utilisé dans les emballages pharmaceutiques.
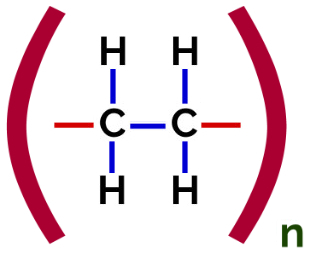
Formule structurelle du polymère d'addition de polyéthylène
À polymérisation de polyéthylène, des molécules d'éthylène (éthène), qui ont une liaison pi entre les deux atomes de carbone, sont utilisées comme monomère. Lorsque cette liaison est rompue, deux valences libres apparaissent, une sur chaque atome de carbone impliqué dans la liaison pi. Les monomères s'unissent exactement dans chacune de ces valences, c'est-à-dire que la valence de l'une est liée à la valence de l'autre, et ainsi de suite.
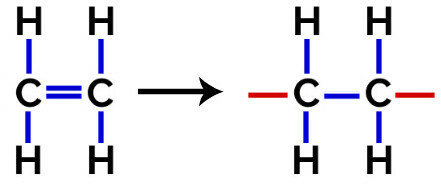
Équation de formation de polyéthylène
b) Réaction de polymérisation par addition 1.4
Dans cette polymérisation, les monomères présentent deux doubles liaisons alternées (une pi et une sigma), ce qui favorise le phénomène de résonance (en alternant la position des électrons pi de la liaison pi), comme dans la formation de caoutchouc synthétique (polybutadiène)

Formule développée du polybutadiène
L'unité monomérique de ce polymère est le butadiène, qui possède deux doubles liaisons alternées. Avec la résonance, la structure a une double liaison entre les carbones 2 et 3, et deux valences libres sur les carbones 1 et 4. C'est précisément dans ces valences libres des carbones 1 et 4 que les monomères se combinent.

résonance butadiène
c) Réaction de polymérisation par condensation ou élimination
C'est une réaction de polymérisation dans laquelle, obligatoirement, deux monomères (identiques ou différents) perdent simultanément des atomes ou des groupes, entraînant deux valences libres dans chacun d'eux. De cette façon, il y a toujours l'élimination de l'hydrogène d'un monomère, qui se joint alors à un halogène (F, Cl, Br, I), OH, NH2, ou au CN de l'autre monomère.
Ainsi, dans le polymérisation par élimination, il y a toujours formation d'eau, d'acide halogéné (HCl, HI, HF, HBr), d'ammoniac (NH3) ou de l'acide cyanhydrique (HCN) en plus du polymère. Voir, par exemple, la représentation de la formation du polyester, matériau utilisé comme tissu :

Équation de formation de polyester
Les monomères formateurs de polyester sont l'acide p-benzènedioïque et l'éthane-1,2-diol. Nous pouvons observer que dans ce polymérisation l'élimination des molécules d'eau se produit, puisque les deux monomères ont deux hydroxyles. Dans ce processus, l'acide perd les deux hydroxyles et le dialcool ne perd que l'hydrogène de ses hydroxyles :

Structure en polyester
Les monomères de polyester sont liés par l'oxygène dans l'alcool et le carbone dans l'acide carboxylique.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-polimerizacao.htm
