Les composés organiques peuvent être représentés de diverses manières, telles qu'une formule structurelle plate, une formule structurelle simplifiée ou condensée ou une formule en tirets. Cependant, la représentation la plus simple est via la formule moléculaire.

Voyons donc comment déterminer la formule moléculaire des composés organiques, à partir des autres formules mentionnées ci-dessus.
1. Grâce à la formule structurelle plate :cette formule montre l'arrangement ou l'arrangement des atomes dans la molécule. Par exemple, ci-dessous est la formule structurelle plate de l'un des hydrocarbures présents dans l'essence.

Notez que, dans cette formule, tous les atomes et toutes les liaisons existantes entre eux sont indiqués. Maintenant, pour déterminer la formule moléculaire de ce composé, il suffit de compter le nombre d'atomes de chaque élément et de placer un index en bas à droite de l'élément en question.
Un aspect important à souligner est que nous commençons toujours la formule moléculaire des composés organiques à partir de l'élément carbone
, car c'est le constituant principal de ces substances. Voir l'exemple :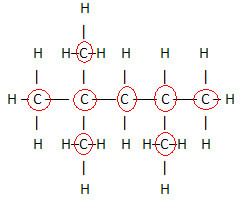
Puisqu'il y a 8 carbones, nous commençons à écrire la formule moléculaire comme ceci: Ç8
Pour compléter cette formule, on compte la quantité d'hydrogènes :
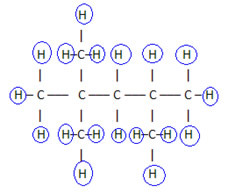
par conséquent, votre formule moléculaire é Ç8H18.
2. Par la formule structurelle simplifiée ou condensée : dans ce type de formule, la quantité d'hydrogènes est abrégée. Par exemple, regardez la même formule pour la molécule trouvée dans l'essence, maintenant sous une forme condensée :
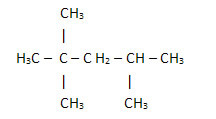
De cette façon, il est encore plus facile de compter la quantité d'hydrogènes, il suffit d'ajouter les indices (3 +3+ 3 +2 +1 +3 +3 = 18).
Mais regardons maintenant la formule structurelle condensée de l'acide linoléique, qui existe dans les légumes comme le coton, le soja, le tournesol, etc. et qui est utilisé dans les peintures et vernis :
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2COOH
En comptant la quantité de carbones, d'hydrogènes et d'oxygènes, nous avons ce qui suit formule moléculaire d'acide linoléique: Ç18H32O2.
3. Grâce à la formule de course : cette formule simplifie encore la façon de représenter les composés organiques, car elle omet les groupes C, CH, CH2 et CH3.
Un exemple est la molécule linoléique, voyez à quoi elle ressemble :

Comptons d'abord la quantité de carbones, en rappelant que, dans cette formule, chaque liaison entre carbones est représentée par le tiret. Ainsi, les pointes, ainsi que les deux points d'inflexion, correspondent à des atomes de carbone.
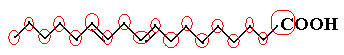
Nous avons donc: Ç18
Maintenant, pour compter la quantité d'hydrogènes, nous devons nous rappeler que les liaisons entre les carbones et les hydrogènes sont impliquées, car le carbone est connu pour faire quatre liaisons; ainsi, la quantité de liaisons manquantes est la quantité d'hydrogène lié à cet élément.
Voir les explications ci-dessous :
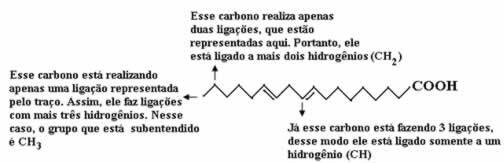
Ainsi, la quantité d'hydrogènes sera: 32.

La quantité d'oxygène est assez simple à compter, car il n'y en a que deux. Depuis le formule moléculaire é: Ç18H32O2.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
