Les transformations de gaz sont des processus dans lesquels un gaz peut avoir un ou plusieurs de ses paramètres de pression, le volume et Températuremodifié. Il existe des transformations gazeuses particulières dans lesquelles au moins une de ces quantités est maintenue constante.
Les types de transformations de gaz sont :
transformation isobare;
transformation isotherme;
transformation isovolumétrique;
transformation adiabatique.
Voir aussi :Thermologie — l'étude des phénomènes liés à la chaleur et à la température
transformation isotherme
La transformation isotherme est celle dans laquelle le la température d'un gaz reste constante. Dans ce type de transformation, la pression et le volume sontinversementproportionnel, de sorte qu'en augmentant le pression, le volume est réduit et vice versa.
Les transformations isothermes sont décrites par Lsalut boyle mariotte. Selon cette loi, le produit entre la pression et le volume d'un gaz parfait est constant :

POURje et POURF – pression initiale et finale
Vje et VF – vitesse initiale et finale
K - constant
transformation isobare
La transformation isobare est caractérisée par une variation de volume et Température, en maintenant la pression constante. Ce type de transformation est décrit mathématiquement par la loi de Charles et Gay Lussac. Lors d'une transformation isobare, la température et le volume sont directement proportionnels, c'est-à-dire qu'ils conservent constante la pression d'un gaz, le volume qu'il occupe augmentera avec l'augmentation de la température du gaz. gaz.
Voir la formule utilisée par Loi Gay-Lussac:
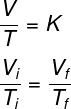
Tje et TF – température initiale et finale
Selon le La loi Gay-Lussac, le rapport entre le volume et la pression d'un gaz, lors d'une transformation isobare, est égal à une constante.
Transformation isovolumétrique
La transformation isovolumétrique, isométrique ou isochore est le nom du processus dans lequel un gaz parfait subit des changements de pression et de température, se maintenant constant ton le volume. Ce type de transformation de gaz, qui a lieu à l'intérieur de conteneurs à parois rigides, est défini mathématiquement par le la loi de Charles.
Selon cette loi, le rapport entre la pression et la température d'un gaz parfait est toujours constant. De plus, dans ce type de transformation, la pression et la température sont directement proportionnel: en doublant la pression, on double la température et vice versa.
La formule qui décrit le comportement des gaz parfaits lors des transformations isovolumétriques est la suivante :
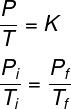
A lire aussi: Thermodynamique - un domaine de la physique qui étudie les phénomènes dans lesquels il y a un échange de chaleur
transformation adiabatique
La transformation adiabatique est le nom du processus subi par un gaz qui ne change pas Chauffer avec l'environnement extérieur ou avec les parois de son conteneur. La formule qui explique mathématiquement le comportement d'un gaz parfait qui subit une transformation adiabatique indique que le produit entre la pression et le volume porté à une constante γ est constant.

La constante dépend de la degrésdansliberté du gaz, c'est-à-dire le nombre de directions dans lesquelles les molécules de gaz peuvent se déplacer. Il peut également être calculé par le rapport entre le chaleur spécifique dans pressionconstant et Chaufferspécifique dans le volumeconstant.
Exemples de transformations de gaz
transformation isotherme – toute dilatation ou contraction lente d'un gaz qui se produit à température constante.
transformation isobare – refroidir le gaz contenu dans une vessie placée à refroidir dans un réfrigérateur.
Transformation isovolumétrique – chauffer complètement la vapeur d'eau confinée dans un autocuiseur.
transformation adiabatique – gaz expulsé par un aérosol.

Voir aussi: Calorimétrie – formules, concepts et exercices résolus
Exercices résolus sur les transformations de gaz
Question 1 - Passez en revue les alternatives ci-dessous et cochez la réponse qui ne contient que de vraies alternatives.
I – Les transformations isothermes sont celles dans lesquelles la température du gaz est maintenue constante.
II – Les transformations adiabatiques impliquent des échanges thermiques entre le gaz et le milieu extérieur.
III – La transformation isochore est celle dans laquelle la pression du gaz est maintenue constante.
IV – Les transformations isobares se produisent avec une pression constante.
Sont corrects:
a) I et II.
b) I, II et III.
c) II et III.
d) I et IV.
Résolution:
Les alternatives II et III sont fausses, car les transformations adiabatiques n'impliquent pas d'échange de chaleur et les transformations isochores sont celles qui se produisent dans des volumes constants. Ainsi, la bonne alternative est la lettre D.
Question 2 -Un gaz parfait subit une transformation rapide, de sorte que sa température, sa pression et son volume subissent des changements soudains en peu de temps. D'après sa connaissance des transformations gazeuses, la transformation subie par le gaz était :
a) isotherme.
b) isobare.
c) adiabatique.
d) isovolumétrique.
Résolution:
Les transformations adiabatiques se produisent rapidement, le gaz n'a donc pas le temps d'échanger de la chaleur avec l'environnement extérieur. Dans ce type de transformation, les paramètres de pression, de volume et de température changent brusquement. Ainsi, la bonne alternative est la lettre C.
Par Rafael Hellerbrock
Professeur de physique
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/transformacoes-gasosas.htm
