Ce mélange de gaz donne naissance à des mélanges ou solutions gazeuses homogènes. Par exemple, les gaz qui sortent des cheminées d'usine ou des pots d'échappement des voitures se répandent dans l'air atmosphérique et, avec le temps, nous n'avons plus pu les distinguer, car il y avait une diffusion de ces gaz à travers le air.

Les gaz émis par les cheminées sont diffusés et « perdus » dans l'air atmosphérique, car le volume d'air est bien supérieur à celui des fumées.
| LES la diffusion d'un gaz est un mouvement spontané d'un gaz à travers un autre, c'est-à-dire sa propagation dans un autre milieu gazeux. |
| LES effusion de gaz est un type particulier de diffusion, dans lequel il y a fuite de gaz à travers de petits trous (ou parois poreuses, qui est un ensemble de petits trous). |
Par exemple, les ballons vendus aux enfants sont remplis d'hélium. Au fil du temps, ce gaz finit par traverser les pores en caoutchouc du ballon, c'est-à-dire qu'il y a son épanchement. Ceci est démontré par le fait que le ballon se dégonfle au bout de quelques heures.
Le chimiste écossais Thomas Graham, en 1829, a étudié ce comportement des gaz. Il a conclu que la vitesse à laquelle un gaz se diffuse ou s'épanche dans un autre est liée à sa densité. Comme ses données expérimentales se sont répétées pour tous les gaz, il a créé la loi suivante qui porte son nom :
La loi de Graham: la vitesse de diffusion ou d'effusion d'un gaz est inversement proportionnelle à la racine carrée de sa densité.
Mathématiquement, cette loi peut être exprimée par l'équation :
v 
Soit, en rapportant deux gaz différents, on a :
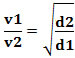
L'unité utilisée dans ce cas est le « volume qui s'échappe par unité de temps »; donc généralement L/min (litres par minute).
Ainsi, les gaz à plus faible densité diffusent plus rapidement. S'il est dans les mêmes conditions de température et de pression, vous pouvez également établir une relation avec la masse molaire du gaz: plus la densité du gaz est élevée, plus sa masse molaire est grande et plus sa vitesse de la diffusion; et vice versa. Ainsi, nous avons :
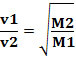
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
