Les alcools peuvent subir une oxydation lorsqu'ils sont exposés à un agent oxydant, tel qu'une solution aqueuse de dichromate de potassium (K2Cr2O7) ou le permanganate de potassium (KMnO4) en milieu acide.
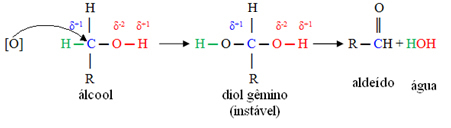
Un oxygène naissant [O] au milieu va attaquer le carbone lié à la fonction alcool (hydroxyle - OH), formant un composé très instable, appelé double diol, qui a deux hydroxyles liés au même carbone. Comme il est instable, ce composé libère de l'eau et donne naissance à un nouveau produit.
Ce produit dépendra du type d'alcool qui a été oxydé, qu'il soit primaire, secondaire, tertiaire ou méthanol.
Brièvement, nous avons :
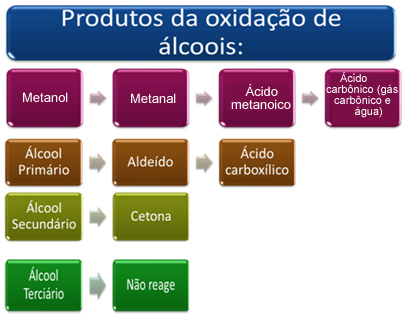
Voir chaque cas ci-dessous :
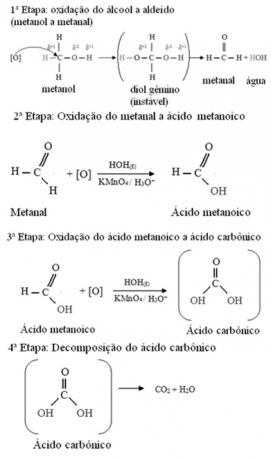
- Méthanol (H3C─ OH) :
Le méthanol est le seul alcool qui a trois hydrogènes liés au carbone qui subira une oxydation. Dans ce cas, puisqu'il y a trois points sur la molécule qu'un oxygène naissant peut attaquer, trois oxydations successives vont se produire, comme le montre le schéma ci-dessous :
- Alcools primaires :
Dans ces composés, le carbone hydroxyle est lié à un seul atome de carbone, c'est-à-dire que les deux autres ligands sont des hydrogènes, et il y a deux endroits pour que l'oxygène naissant s'attaque.
Tout d'abord, il y aura la formation d'un aldéhyde, comme indiqué ci-dessous :
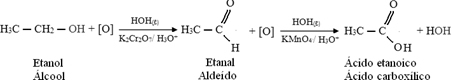
Mais, l'oxydation continue, car les réactifs utilisés pour oxyder l'alcool sont plus forts que ceux utilisés pour oxyder un aldéhyde. Ensuite, un autre oxygène naissant attaque le carbone carbonyle et produit un acide carboxylique.
Ce qui suit est un exemple, l'oxydation de l'éthanol, d'abord en éthanal puis en acide éthanoïque (acide acétique). Cette réaction totale est la transformation du vin en vinaigre.
L'oxydation partielle de l'éthanol en éthanal se produit lorsqu'une personne alcoolique passe un alcootest jetable. A l'intérieur de cet appareil se trouve un mélange solide de bichromate de potassium et de silice en milieu acide, avec la réaction suivante se produisant :
K2Cr2O7(aq) + 4H2SEUL4(aq) + 3 CH3CH2Oh(g) → Cr2(SEUL4)3(aq) + 7h2O(1) + 3 CH3CHO(g) + K2SEUL4(aq)
Orangeéthanol (incolore)vertéthanal (incolore)
A noter qu'en plus de l'oxydation de l'éthanol (alcool) en éthanol (aldéhyde), il y a une réduction simultanée du bichromate, qui est orange, en chrome (III), voire en chrome (II), qui est vert. Le changement de couleur indiquera que la personne a plus d'alcool dans le sang que ce qui est autorisé.
- Alcools secondaires :
Ce sont des composés dans lesquels le carbone hydroxyle est lié à deux autres atomes de carbone et à un seul atome d'hydrogène. Par conséquent, il n'y aura qu'un seul endroit dans la molécule où l'oxygène naissant pourra attaquer et un seul type de produit se formera, qui sera toujours une cétone :
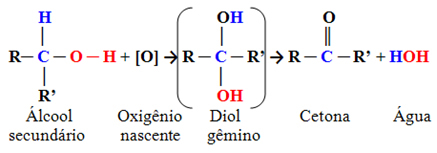
Étant donné que le carbone carbonyle d'une cétone n'a pas d'hydrogène lié directement, il n'y a plus aucune possibilité d'oxydation supplémentaire. Par conséquent, la réaction s'arrête à la cétone.
- Alcools tertiaires :
Les alcools tertiaires sont ceux dans lesquels le carbone qui a le groupe -OH fait trois liaisons avec d'autres atomes de carbone. Puisqu'ils ne se lient pas aux hydrogènes, il n'y a aucun point sur la molécule qui puisse être attaqué par l'oxygène naissant. De ce fait, les alcools tertiaires ne subissent pas d'oxydation.
* La source et auteur de l'image: CostaPPPR.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/oxidacao-dos-alcoois.htm
