est appelé modèle Rutherford la proposition faite pour l'atome par le scientifique Ernest Rutherford en 1911, dans le but de démontrer la forme et la composition idéalisées du constituant de la matière: le atome.
O modèle Rutherford il est communément appelé le modèle du système solaire, car sa structure et son fonctionnement ont été comparés à la relation entre le soleil et les planètes qui tournent autour de lui.
Dans son modèle, Rutherford a comparé le soleil au noyau de l'atome, et les électrons de l'atome ont été comparés aux planètes du système solaire, comme on peut le voir dans la représentation suivante :
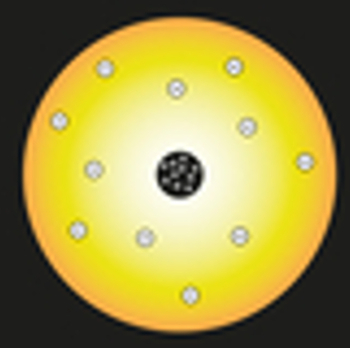
Représentation du modèle atomique de Rutherford
À l'intérieur du noyau, des particules chargées positivement, appelées protons (découverts par Eugen Goldstein), seraient positionnées. Ce noyau serait petit et dense et aurait la plus grande masse de l'atome.
L'expérience menée par Rutherford
Toutes les propositions de Rutherford pour la création de son modèle atomique étaient le résultat d'une expérience dans laquelle il concentrait des faisceaux de rayonnement alpha (provenant de de polonium radioactif présent dans une boîte en plomb) sur une fine plaque d'or, avec une plaque métallique recouverte de sulfure de zinc derrière et sur les côtés. côtés. Le sulfure de zinc est un sel qui, lorsqu'il reçoit un rayonnement, brille.
Rutherford a ensuite noté que trois points (a, b, c) en particulier brillaient au cours de cette expérience :
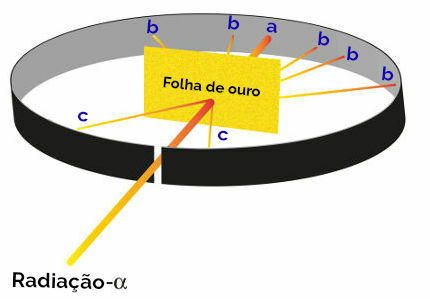
Représentation de l'expérience de Rutherford
pointer un (incidence de brillance plus élevée): indiquait que le rayonnement alpha traversait la plaque d'or sans problème, car il le serait en direction du trou d'ouverture du bloc de plomb ;
point b (petite incidence de lueur): indiquait que le rayonnement alpha traversait la plaque d'or, mais qu'il aurait dévié lors de la traversée ;
point c (une quantité extrêmement faible de lueur): situé devant la lame d'or, indiquait que le rayonnement alpha ne passait pas à travers.
Rutherford a attribué ces résultats observés aux atomes qui forment la plaque d'or, interprétant comme suit :
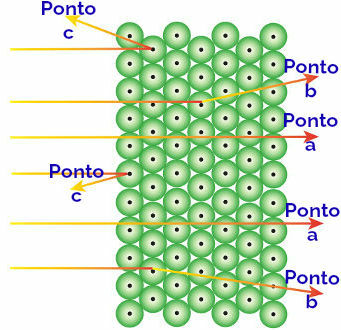
Représentation du comportement du rayonnement alpha et des atomes
Le rayonnement alpha atteint le pointer vers: le rayonnement alpha est positif et traverse une région de l'atome d'immenses espaces vides. Il y a aussi des électrons présents dans certaines orbitales.
Le rayonnement alpha atteint le point b: le rayonnement alpha traverse les atomes de la plaque d'or, mais il atteint un certain moment où il passe à proximité du petit noyau de l'atome, qui est chargé positivement, générant une répulsion dans le radiation.
Le rayonnement alpha atteint le point c: le rayonnement alpha traverse les atomes de la plaque d'or, mais il frappe un petit noyau, qui est chargé positivement, générant une répulsion dans le rayonnement.
Problématique du modèle de Rutherford
De nombreux physiciens ont signalé certains problèmes dans le modèle proposé par Rutherford :
1er problème: comment un noyau chargé positivement serait-il possible si des particules chargées positivement se repoussent ?
2ème problème: pourquoi les électrons des électrosphères ne sont pas attirés par les protons du noyau ?
3ème problème: pourquoi les électrons, qui sont de petits corps en mouvement constant, ne perdent-ils pas de l'énergie et ne tombent-ils pas dans le noyau ?
* Crédits images: Svic / Shutterstock
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm
