LES titrage est une procédure de laboratoire utilisée pour déterminer la concentration en quantité de matière (ou concentration en mol/L) d'une solution contenant un acide ou une base.
Pendant le titrage, il y a toujours un mélange de solutions contenant différents solutés avec apparition d'une réaction chimique. Comme les solutions mixtes ont toujours un acide et une base, la réaction chimique qui a lieu est donc une neutralisation.
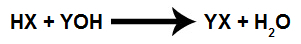
Équation chimique représentant un titrage.
Le processus de détermination de la concentration molaire d'une solution inconnue pendant titrage dépend des facteurs suivants :
• Connaître la concentration molaire de la solution qui sera mélangée à l'inconnue ;
• Connaître le volume de la solution de concentration inconnue ;
• Connaître le volume de solution de concentration connue.
Formule utilisée dans un titrage
Et en titrage une neutralisation se produit (nombre égal de moles d'acide et de base), on peut utiliser la formule suivante pour déterminer la concentration molaire de la solution inconnue :
nonLes = nB
MLes.VLes = MB.VB
Noter: Le nombre de moles est le produit entre la concentration molaire (M) et le volume d'une solution (V).
Matériel nécessaire pour obtenir un diplôme
• Burette: équipement utilisé pour mesurer le volume de solution de concentration connue ;

• Erlenmeyer: équipement utilisé pour recevoir la solution de concentration inconnue ;
• Support universel: équipement sur lequel est fixée la griffe;

• Griffe: équipement utilisé pour tenir la burette;

• Agitateur magnétique: équipement utilisé pour agiter la solution présente dans l'erlenmeyer.

Étapes d'un diplôme
-
1ère étape : fixer la burette au support universel à l'aide de la griffe ;
-
2ème étape : positionner l'erlenmeyer sur l'agitateur magnétique ;
-
3ème étape : ajouter un certain volume, à l'intérieur de l'erlenmeyer, de la solution de concentration inconnue. Par exemple: ajouter 10 mL de la solution dans l'erlenmeyer ;
- 4ème étape: ajouter de la phénolphtaléine à la solution présente dans l'erlenmeyer.
Remarque: Si la solution dans l'erlenmeyer est acide, lors de l'ajout de la phénolphtaléine, la solution restera inchangée en couleur, cependant, si la solution est basique, elle sera rose rougeâtre.

Phénolphtaléine ajoutée à une solution caractéristique basique.
-
5ème étape : ajouter une barre magnétique à l'intérieur de l'erlenmeyer. Ensuite, allumez l'agitateur magnétique pour que le liquide à l'intérieur de l'Erlenmeyer soit agité ;
-
6ème étape : ajouter à l'intérieur de la burette, jusqu'à sa capacité maximale, un volume d'une solution de concentration connue, c'est-à-dire, si la burette est de 50 mL, ajouter 50 mL de cette solution.
- 7ème étape : ouvrir la valve de la burette et laisser le liquide de son intérieur tomber dans l'erlenmeyer.
Observations faites pendant le titrage
Dès que la burette est ouverte sur l'erlenmeyer, la réaction de neutralisation commence, c'est-à-dire que l'acide réagit avec la base en formant progressivement du sel et de l'eau.
Comme la réaction de neutralisation se produit avec le mélange, la couleur de la solution présente dans le erlenmeyer change aussi progressivement, ce que nous appelons le tournant, comme suit :
- Si c'était incolore, ça commence à avoir l'air roserougeâtre,
- si c'étaitroserougeâtre, commence à devenir incolore.
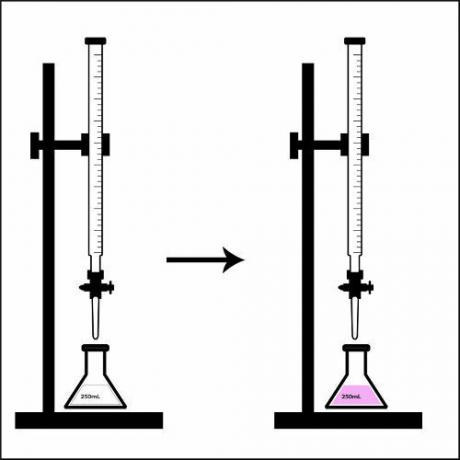
Représentation du point tournant dans un titrage.
Lorsque la solution présente dans l'erlenmeyer change complètement de couleur, c'est-à-dire qu'elle a atteint le point de retournement, on dit que le titrage est terminé. A ce moment, il suffit de vérifier le volume utilisé de la solution de concentration connue qui se trouvait sur la burette.
De la somme entre le volume de la solution de concentration connue, qui a été déterminé dans la burette, et volume de la solution inconnue, qui était l'erlenmeyer, nous sommes en mesure de déterminer sa concentration molaire.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-titulacao.htm


