réactions avec oxydes basiques sont des phénomènes chimiques dans lesquels une substance de cette classe d'oxydes est placée dans le même récipient qu'un acide inorganique, une oxyde d'acide ou une oxyde amphotère.
Voir aussi :Réactions avec les oxydes amphotères
sel inorganique et l'eau sont des produits courants dans un réaction avec les oxydes basiques. Pour savoir si du sel inorganique ou de l'eau seront produits, il faut regarder la substance qui accompagne l'oxyde basique dans le réactif. Voir les exemples ci-dessous et comprendre comment ce processus se déroule.
Réactions avec les oxydes basiques et les acides inorganiques
Dans les réactions entre les oxydes basiques et les acides inorganiques, un sel inorganique et de l'eau se forment, car le cation oxyde basique (Y+) interagit avec l'anion (X-) de l'acide, et le cation hydronium (H+) de l'acide interagit avec l'anion de l'oxyde :
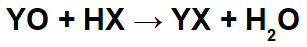
Exemple: Oxyde de radium et acide bromhydrique
Dans cette réaction, nous avons l'oxyde de radium (RaO) et l'acide bromhydrique (Hbr) comme réactifs. Ainsi, les interactions suivantes se produisent :
Radio-cation (Ra+2) avec l'anion bromure (Br-1) formant le sel de bromure de radium (RaBr2).
Cation hydronium (H+1) avec l'anion oxyde (O-2) formant de l'eau (H2O).
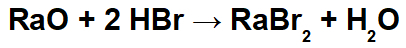
Voir aussi :Réactions avec les oxydes doubles
Réactions avec les oxydes basiques et les oxydes acides
Dans ces réactions, un sel inorganique est formé par l'interaction entre le cation oxyde basique (Y+) et l'anion acide résultant (WOLes-) de la réaction chimique entre un oxyde acide et l'eau.
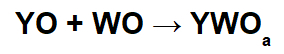
Exemple: Oxyde de sodium et dioxyde de soufre
Dans cette réaction, nous avons de l'oxyde de sodium (Na2O) et le dioxyde de soufre (SO2). Il est à noter que, dans un premier temps, lorsque l'oxyde acide interagit avec l'eau, on a la formation d'acide sulfureux (H2SEUL3):

A partir de la formation de cet acide, l'interaction entre le cation sodium (Na+1) de l'oxyde basique et de l'anion sulfite (SO3-2) de l'acide, formant le sel de sulfite de sodium (Na2SEUL3):
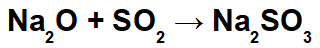
Réactions avec les oxydes basiques et les oxydes amphotères
Les oxydes amphotères sont des substances qui présentent un double comportement chimique: en présence d'une substance acide, elle se comporte comme un oxyde basique; en présence d'une substance de nature basique, il se comporte comme un oxyde acide.
Alors quand un l'oxyde basique réagit avec un oxyde amphotère, celui-ci se comportera comme un oxyde acide, formant un acide inorganique en présence d'eau. La réaction entre l'anion de l'acide inorganique et le cation de l'oxyde basique formera un sel produit.
Exemple: Oxyde de potassium et oxyde de chrome III
Dans cette réaction, nous avons de l'oxyde de potassium comme réactifs (K2O) et l'oxyde de chrome (Cr2O3). Il est à noter que, initialement, lorsque l'oxyde amphotère interagit avec l'eau, nous avons la formation d'acide chromosomique (2HCrO2):

A partir de la formation de cet acide, l'interaction entre le cation potassium se produit (K+1) de l'oxyde basique et de l'anion chromite (SO3-2) de l'acide, formant le sel de chromite de potassium (2KCrO2):

Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm
