Kp est l'acronyme utilisé pour déterminer la constante d'un équilibre en termes de pressions partielles. Cette constante travaille avec les valeurs des participants gazeux d'un équilibre dans l'unité atm, par exemple.

Équation représentant une réaction chimique avec des composants gazeux
Dans cette équation, tous les participants sont gazeux, donc lorsqu'un gaz participant a un pression partielle dans le mélange, il est représenté par l'abréviation pX.
Lors de la mise en place de l'équation d'équilibre chimique (en termes de concentration), les produits doivent être placés au numérateur et les réactifs sont placés au dénominateur :
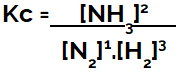
Kc expression de l'équilibre de formation d'ammoniac
l'expression de constante d'équilibre en termes de pression (Kp) suit le modèle de Kc, c'est-à-dire que les pressions partielles des réactifs sont positionnées au dénominateur et les pressions partielles des produits au numérateur :
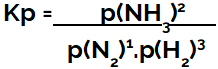
Kp expression de l'équilibre de formation d'ammoniac
Observation: Si l'équation de réaction du
équilibre chimique ne présenter aucun participant gazeux, il ne présentera pas automatiquement Kp.Exemple: (PUC-MG) Pour la réaction: 2 CO(g) + O2(g)? 2 CO2(g), les pressions partielles de CO(g) C'est le2(g) à l'équilibre ils sont respectivement de 0,2 atm et 0,4 atm. La pression totale du système est de 1,4 atm. La valeur de Kp pour la réaction est :
a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
Les données fournies par l'exercice sont :
Pression partielle de monoxyde de carbone (pCO) = 0,2 atm;
Pression partielle de monoxyde de carbone (pO2) = 0,4 atm ;
Pression totale = 1,4 atm ;
Pour déterminer le Kp de ce système, nous devons effectuer les étapes suivantes :
1ère étape : Déterminer la pression partielle de monoxyde de carbone (pCO2).
Pour cela, rappelez-vous simplement que la pression totale (pt) est la somme de toutes les pressions partielles :
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2ème étape: Déterminer le Kp de l'exercice.
Pour cela, il suffit d'utiliser les valeurs dans l'expression de la constante d'équilibre Kp :
Kp = (pCO2)2
(pCO)2.(poussière2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
