La chimie organique est un vaste domaine de la chimie qui étudie les composés carbonés.
La connaissance de la Chimie Organique est abordée de plusieurs manières et, en y réfléchissant, nous vous avons concocté des propositions d'exercices, de concours d'entrée et de questions Enem pour vous permettre de tester vos connaissances.
Utilisez également les commentaires des résolutions pour en savoir encore plus sur le sujet.
Exercices proposés
question 1
Regardez les composés organiques ci-dessous et identifiez les fonctions organiques en fonction des groupes fonctionnels mis en évidence. Après cela, nommez les substances.
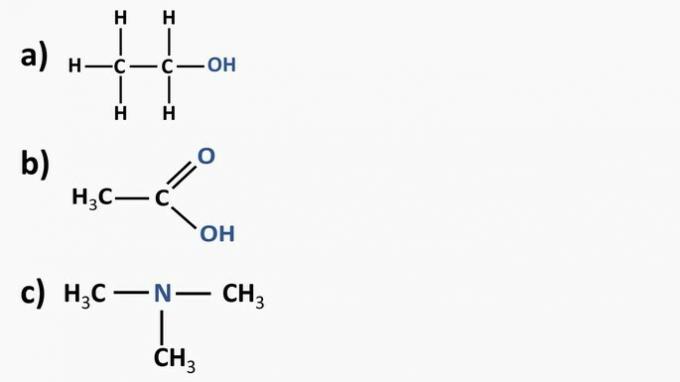
Réponse:
a) Composé organique: éthanol
- fonction organique: alcool
- Formule générale: R-OH
- Identification: hydroxyle (OH) lié à la chaîne carbonée
b) Composé organique: acide éthanoïque.
- Fonction organique: acide carboxylique
- Formule générale: R-COOH
- Identification: radical carboxylique (COOH) lié à la chaîne carbonée
c) Composé organique: triméthylamine
- Fonction organique: amine (tertiaire)
- Formule générale:
- Identification: azote lié à trois chaînes carbonées
question 2
En chimie organique, les composés sont reconnus par les chaînes formées par le carbone et l'hydrogène. Cependant, d'autres éléments peuvent faire partie de la structure chimique de ces composés, comme l'oxygène.
Sélectionnez l'alternative où les deux composés organiques ont des fonctions organiques oxygénées.
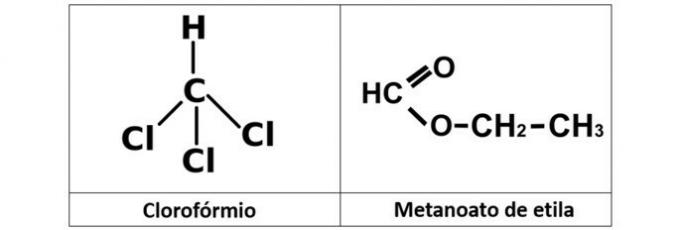
a) chloroforme et méthaneate d'éthyle
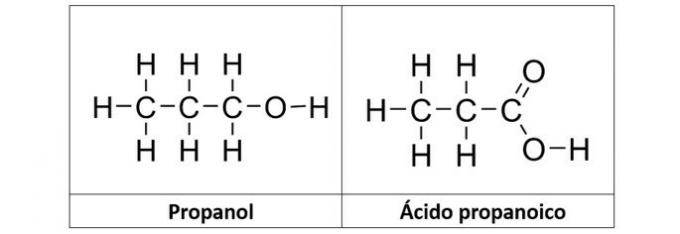
b) propanol et acide propanoïque
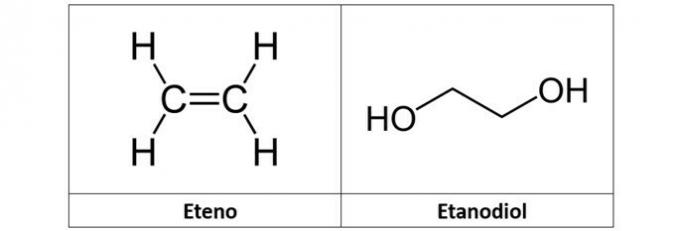
c) éthène et éthanediol
d) éthanamide et benzène
Bonne réponse: b) propanol et acide propanoïque
Un tort. Nous avons du chloroforme (CHCl3), qui est un halogénure d'alkyle, et l'ester méthanoate d'éthyle (C3H6O2), qui contient de l'oxygène dans sa structure.
b) CORRECT. Dans cette alternative, nous avons deux composés qui ont des fonctions organiques oxygénées. Le propanol (C3H8O) est un alcool formé de trois carbones. L'acide propanoïque (C3H6O2) est un acide carboxylique.
c) FAUX. L'éthylène (C2H4), également appelé éthylène, est un hydrocarbure de type alcène. Déjà l'éthanediol (C2H6O2) est un alcool avec deux hydroxyles dans sa structure.
d) FAUX. Ethanamide (C2H5NO) est un amide et le benzène est un hydrocarbure aromatique et, par conséquent, n'est formé que de carbone et d'hydrogène.

question 3
Regardez la structure du composé organique ci-dessous et vérifiez les vraies déclarations.

(01) Le composé a une fonction azotée organique.
(02) C'est une amine primaire, car elle est liée à un seul hydrogène.
(03) Le nom du composé est diéthylamine.
Bonne réponse:
(01) CORRECT. La fonction organique azotée présente dans le composé est une amine.
(02) FAUX. C'est une amine secondaire, car l'azote est lié à deux chaînes carbonées.
(03) FAUX. Le nom du composé est diméthylamine, car il y a deux radicaux méthyle attachés à l'azote.
question 4
L'eugénol, membre de la famille des phénylpropanoïdes, est un composé organique aromatique présent dans le clou de girofle, une épice utilisée depuis l'Antiquité.

Observez la formule structurelle du composé et identifiez les fonctions organiques présentes.
a) Alcool et éther
b) Phénol et éther
c) Alcool et ester
d) Phénol et ester
e) Alcool et hydrocarbure
Alternative correcte: b) Phénol et éther.
L'eugénol a des fonctions organiques oxygénées dans sa chaîne, c'est-à-dire qu'en plus des atomes de carbone et d'hydrogène, l'oxygène est un hétéroatome présent.
La fonction organique phénol est caractérisée par l'hydroxyle (-OH) attaché à un cycle aromatique. Dans la fonction éther, l'oxygène est situé entre deux chaînes carbonées.
question 5
L'EDTA, dont le nom complet est acide éthylènediaminetétraacétique, est un composé organique aux nombreuses applications. Sa capacité à lier les ions métalliques en fait un agent chélatant largement utilisé à la fois en laboratoire et dans l'industrie.
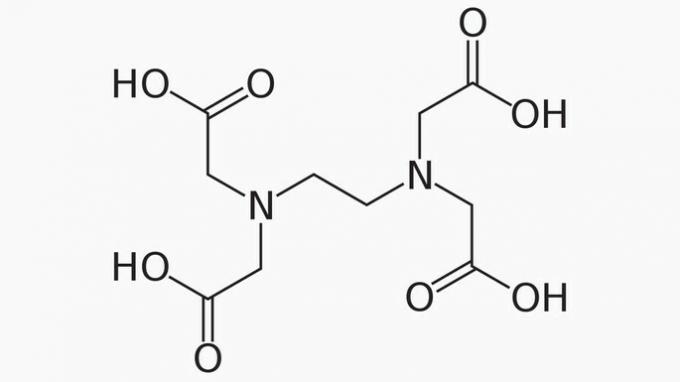
A propos de l'EDTA, il est correct d'affirmer que la chaîne carbonée est :
a) Ouvert, homogène et non saturé.
b) Fermé, hétérogène et saturé.
c) Ouvert, hétérogène et insaturé.
d) Fermé, homogène et saturé.
e) Ouvert, hétérogène et saturé.
Bonne réponse: e) Ouvert, hétérogène et saturé.
La chaîne EDTA est classée en :
OUVERT. D'après l'arrangement des atomes de carbone dans la structure de l'EDTA, on peut voir que, du fait de la présence d'extrémités, la chaîne du composé est ouverte.
HÉTÉROGÈNE. En plus des composés de carbone et d'hydrogène, la chaîne carbonée comporte des hétéroatomes d'azote et d'oxygène.
SATURÉ. Les liaisons entre les atomes de carbone sont saturées, car la chaîne n'a que des liaisons simples.
En savoir plus sur: Chimie organique.
questions d'examen d'entrée
question 1
(UFSC) Observez les structures organiques incomplètes et identifiez le(s) élément(s) correct(s) :
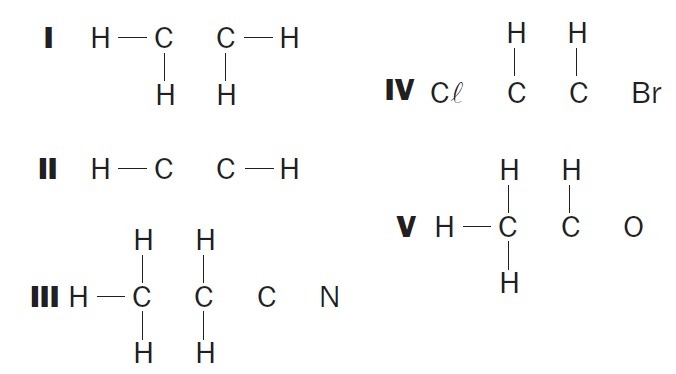
(01) La structure I manque d'une simple liaison entre les atomes de carbone.
(02) La structure II manque d'une triple liaison entre les atomes de carbone.
(03) La structure III manque de deux liaisons simples entre les atomes de carbone et d'un triple entre les atomes de carbone et d'azote.
(04) La structure IV manque de deux liaisons simples entre les atomes de carbone et les halogènes et d'une double liaison entre les atomes de carbone.
(05) La structure V manque d'une simple liaison entre les atomes de carbone et d'une simple liaison entre les atomes de carbone et d'oxygène.
Alternatives correctes: 02, 03 et 04.
En plus du carbone, un élément chimique obligatoire dans les composés organiques, d'autres éléments peuvent être présents dans les structures et liés par des liaisons covalentes, où les électrons sont partagés.
La valence des éléments détermine le nombre de liaisons qui peuvent être formées, comme indiqué dans le tableau ci-dessous.
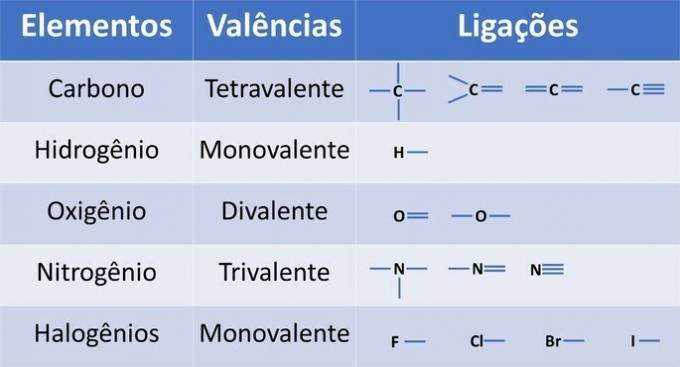
A partir de ces informations, nous avons :
(01) FAUX. La structure manque d'une double liaison entre les atomes de carbone pour former le composé éthène.
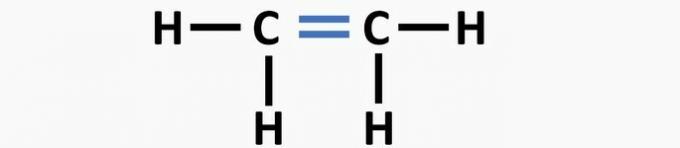
(02) CORRECT. La structure manque d'une triple liaison entre les atomes de carbone pour former le composé éthyne.
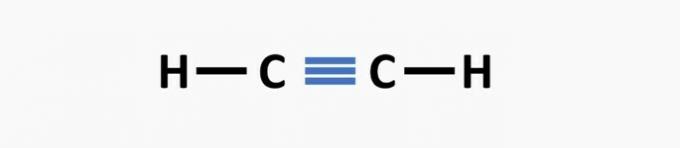
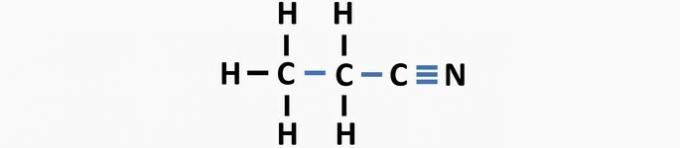
(03) CORRECT. La structure manque de liaisons simples entre les carbones et de triples liaisons entre le carbone et l'azote pour former le composé propanenitrile.
(04) CORRECT. La structure manque de liaisons simples entre le carbone et l'halogène, et de doubles liaisons entre les carbones pour former le composé dichloroéthène.
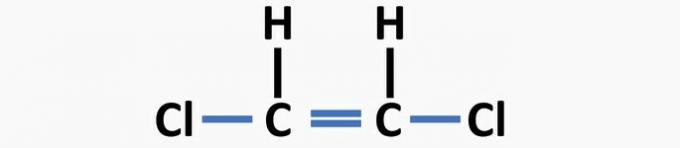
(05) FAUX. La structure manque d'une simple liaison entre les carbones et d'une double liaison entre le carbone et l'oxygène pour former le composé éthanal.
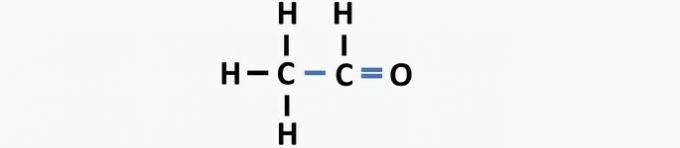
question 2
(UFPB) La structure du composé organique de formule moléculaire C5H8Ce qui présente une chaîne ramifiée, insaturée, hétérogène et alicyclique est :

Alternative correcte: d.
Les chaînes carbonées peuvent être classées comme suit :
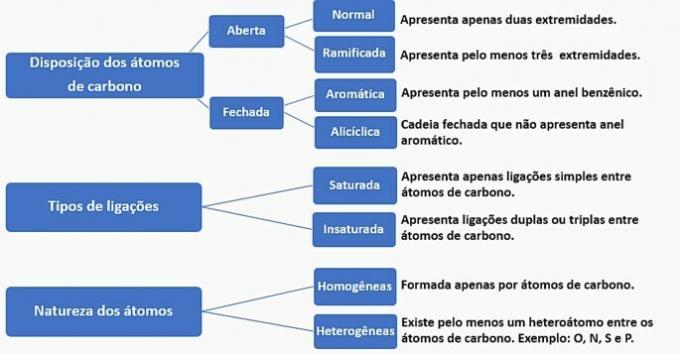
D'après ces informations, nous avons :
Un tort. La chaîne est classée comme normale, saturée, homogène et alicyclique.
b) FAUX. La chaîne est classée comme normale, insaturée, homogène et ouverte.
c) FAUX. La chaîne est classée comme ramifiée, insaturée, homogène et ouverte.
d) CORRECT. La chaîne est classée comme ramifiée, insaturée, hétérogène et alicyclique, comme
- Il a une ramification: radical méthyle ;
- A une insaturation: double liaison entre les carbones ;
- Il a un hétéroatome: oxygène lié à deux carbones ;
- Il présente une chaîne fermée: des carbones liés en cercle sans la présence d'un cycle aromatique.
e) FAUX. La chaîne est classée comme ramifiée, insaturée, hétérogène et ouverte.
question 3
(Centec-BA) Dans la structure ci-dessous, les carbones numérotés sont respectivement :
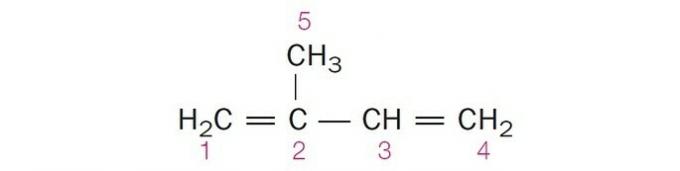
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Alternative correcte: c) sp2, sp2, sp2, sp2, sp3.
Parce qu'il a 4 électrons dans la couche de valence, le carbone est tétravalent, c'est-à-dire qu'il a tendance à former 4 liaisons covalentes. Ces liaisons peuvent être simples, doubles ou triples.
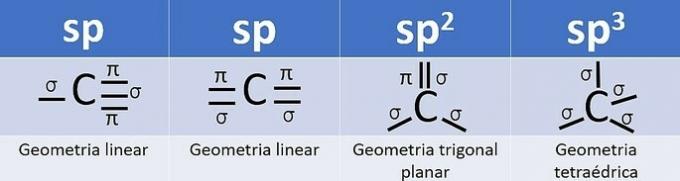
Le nombre d'orbitales hybrides est la somme des liaisons sigma (σ) du carbone, puisque la liaison ne s'hybride pas.
- sp: 2 liens sigma
- sp2: 3 liens sigma
- sp3: 4 liens sigma
D'après ces informations, nous avons :
Un tort. Le carbone 2 a une hybridation sp2, car il a 3 liaisons σ et une liaison .
b) FAUX. Le carbone n'a pas d'hybridation sp4 et l'hybridation sp se produit lorsqu'il existe une triple liaison ou deux doubles liaisons entre les carbones.
c) CORRECT. La somme des liaisons sur chaque carbone donne l'hybridation alternative.
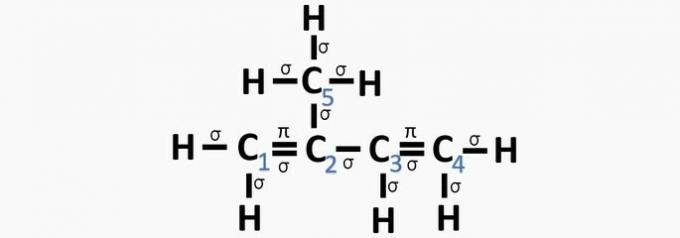
d) FAUX. L'hybridation Sp se produit lorsqu'il existe une triple liaison ou deux doubles liaisons entre les carbones.
e) FAUX. Le carbone n'a pas d'hybridation sp4 et l'hybridation sp se produit lorsqu'il existe une triple liaison ou deux doubles liaisons entre les carbones.
question 4
(UFF) Il existe un échantillon gazeux formé par l'un des composés suivants: CH4; Ç2H4; Ç2H6; Ç3H6 ou C3H8. Si 22 g de cet échantillon occupent un volume de 24,6 L à une pression de 0,5 atm et une température de 27 °C (Données: R = 0,082 L .atm. K–1.mol–1), on en conclut qu'il s'agit du gaz :
a) l'éthane.
b) méthane.
c) propane.
d) le propène.
e) éthène.
Alternative correcte: c) propane.
1ère étape: convertir l'unité de température de Celsius en Kelvin.
2ème étape: calculer le nombre de moles du composé à l'aide de l'équation générale des gaz.
3ème étape: calculer la masse molaire du composé.
4ème étape: trouver l'hydrocarbure qui a une masse molaire de 44 g/mol.
Méthane
Éthène
Éthane
propylène
Propane
Ainsi, il est conclu que le gaz qui correspond à l'information dans le relevé est le propane.
question 5
(ITA) Considérez les substances suivantes :
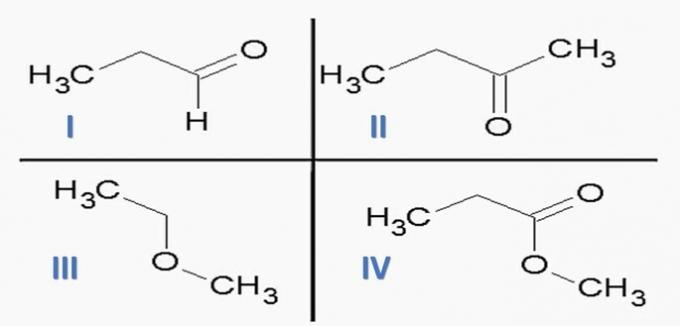
et les fonctions chimiques suivantes :
Le. acide carboxylique;
B. de l'alcool;
ç. aldéhyde;
ré. cétone;
et. ester;
F. éther.
L'option qui associe CORRECTEMENT des substances à des fonctions chimiques est :
aide; IIc; IIIe; IVf.
b) le; IId; IIIe; T.V.A.
c) le; IId; IIIf; IVe.
a fait; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Alternative correcte: c) Ic; IId; IIIf; IVe.
Les fonctions organiques sont déterminées par des structures et regroupent des composés organiques ayant des caractéristiques similaires.
Les fonctions chimiques présentes dans les alternatives sont :
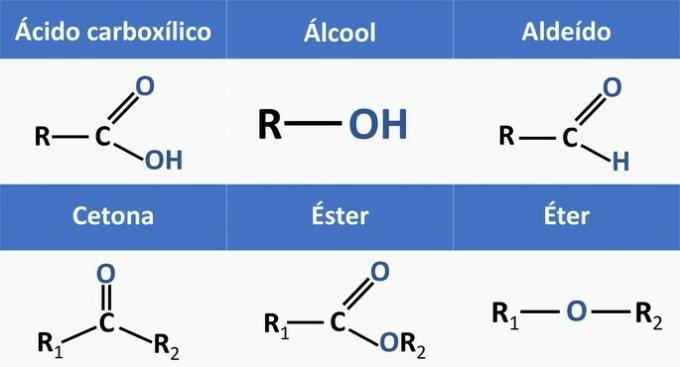
En analysant les structures ci-dessus et les composés présents dans l'énoncé, nous avons :
Un tort. Les fonctions de l'organe sont correctes, mais la séquence est fausse.
b) FAUX. Il n'y a pas d'acide carboxylique parmi les composés.
c) CORRECT. Les groupes fonctionnels présents dans les composés représentent les fonctions chimiques suivantes.

d) FAUX. I est un aldéhyde et II est une cétone.
e) FAUX. Il n'y a pas d'acide carboxylique parmi les composés.
En savoir plus sur: Fonctions organiques.
Questions d'Enem
question 1
(Enem/2014) Une méthode pour déterminer la teneur en éthanol dans l'essence consiste à mélanger des volumes connus d'eau et d'essence dans une bouteille spécifique. Après agitation du ballon et attente, on mesure les volumes des deux phases non miscibles obtenues: l'une organique et l'autre aqueuse. L'éthanol, autrefois miscible à l'essence, est maintenant miscible à l'eau.
Pour expliquer le comportement de l'éthanol avant et après l'ajout d'eau, il faut savoir
a) la densité des liquides.
b) la taille des molécules.
c) le point d'ébullition des liquides.
d) les atomes présents dans les molécules.
e) le type d'interaction entre les molécules.
Alternative correcte: e) le type d'interaction entre les molécules.
Les forces intermoléculaires influencent la solubilité des composés organiques. Les substances ont tendance à se dissoudre entre elles lorsqu'elles ont la même force intermoléculaire.
Voir dans le tableau ci-dessous quelques exemples de fonctions organiques et le type d'interaction entre molécules.
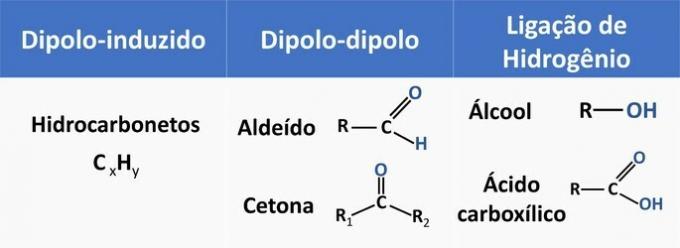
L'éthanol est considéré comme un solvant polaire, car il possède un groupe polaire (-OH) dans sa structure. Cependant, sa chaîne carbonée, étant apolaire (CH) est capable d'interagir avec des solvants apolaires. Par conséquent, l'éthanol se solubilise à la fois dans l'eau et dans l'essence.
D'après ces informations, nous avons :
Un tort. La densité rapporte la masse d'un corps au volume occupé.
b) FAUX. La taille des molécules influence la polarité des composés: plus la chaîne carbonée est grande, plus la substance devient non polaire.
c) FAUX. Le point d'ébullition est utile pour séparer les molécules: la distillation sépare les composés ayant des points d'ébullition différents. Plus le point d'ébullition est bas, plus la molécule se vaporise facilement.
d) FAUX. Un aldéhyde a du carbone, de l'hydrogène et de l'oxygène dans sa structure. Ce composé réalise des interactions dipôle-dipôle, tandis qu'un alcool, ayant les mêmes éléments, est capable de former des liaisons hydrogène.
e) CORRECT. L'interaction de l'éthanol avec l'eau (liaison hydrogène) est plus intense qu'avec l'essence (diplo-induite).
question 2
(Enem/2013) Les molécules de nanoputiens ils ressemblent à des figures humaines et ont été créés pour stimuler l'intérêt des jeunes pour la compréhension du langage exprimé dans les formules structurales, largement utilisé en chimie organique. Un exemple est NanoKid, représenté sur la figure :
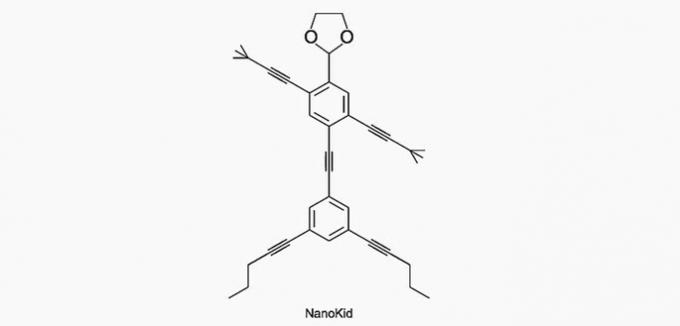
Où se trouve le carbone quaternaire dans le corps du NanoKid ?
a) Les mains.
b) Tête.
c) Poitrine.
d) Abdomen.
e) Les pieds.
Alternative correcte: a) Les mains.
Le carbone est classé comme suit :
- Primaire: se lie à un carbone ;
- Secondaire: se lie à deux carbones ;
- Tertiaire: se lie à trois carbones ;
- Quaternaire: se lie à quatre carbones.
Voir les exemples ci-dessous.

D'après ces informations, nous avons :
a) CORRECT. Le carbone dans la main est lié à quatre autres carbones, il est donc quaternaire.
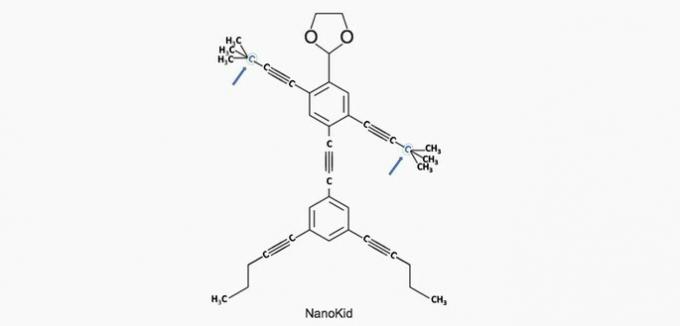
b) FAUX. La tête est constituée de carbones primaires.
c) FAUX. La poitrine est composée de carbones secondaires et tertiaires.
d) FAUX. L'abdomen est constitué de carbones secondaires.
e) FAUX. Les pieds sont en carbone primaire.
question 3
(Enem/2014) Certains matériaux polymères ne peuvent pas être utilisés pour la production de certains types d'artefacts, que ce soit pour limitations des propriétés mécaniques, soit par la facilité avec laquelle ils subissent une dégradation, générant des sous-produits indésirables pour cela application. Par conséquent, l'inspection devient importante pour déterminer la nature du polymère utilisé dans la fabrication de l'artefact. Une des méthodes possibles repose sur la décomposition du polymère pour générer les monomères qui lui ont donné naissance.
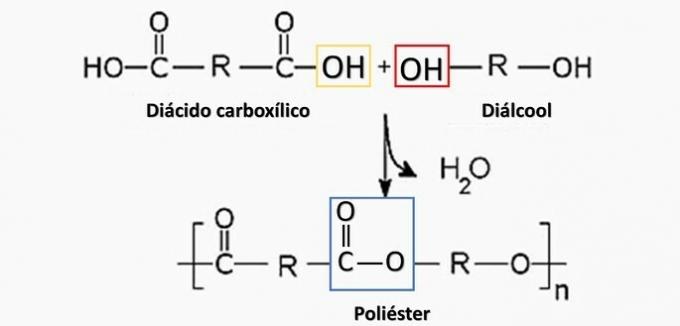
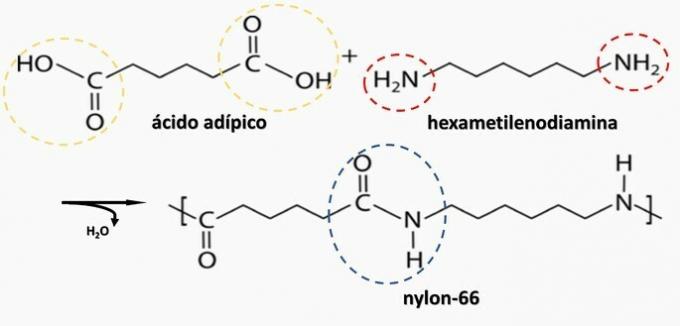
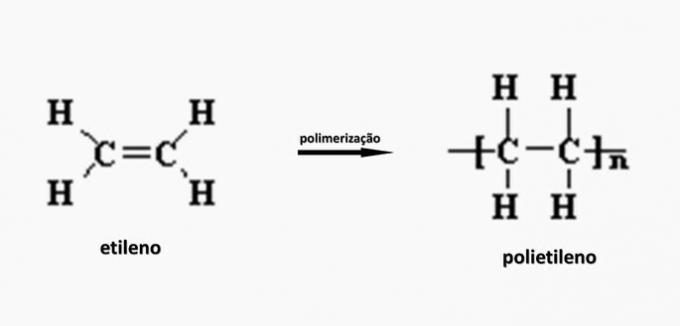
Décomposition contrôlée d'un artéfact généré diamine H2N(CH2)6NH2 et le diacide HO2C(CH2)4CO2H. Par conséquent, l'artefact a été fait de
a) polyester.
b) polyamide.
c) polyéthylène.
d) polyacrylate.
e) polypropylène.
Alternative correcte: b) polyamide.
Un tort. Le polyester se forme lors de la réaction entre un acide dicarboxylique (-COOH) et un dialcool (-OH).
b) CORRECT. Le polyamide est formé par la polymérisation d'un acide dicarboxylique (-COOH) avec une diamine (-NH2).
c) FAUX. Le polyéthylène est formé lors de la polymérisation du monomère d'éthylène.
d) FAUX. Le polyacrylate est formé par un sel dérivé de l'acide carboxylique.
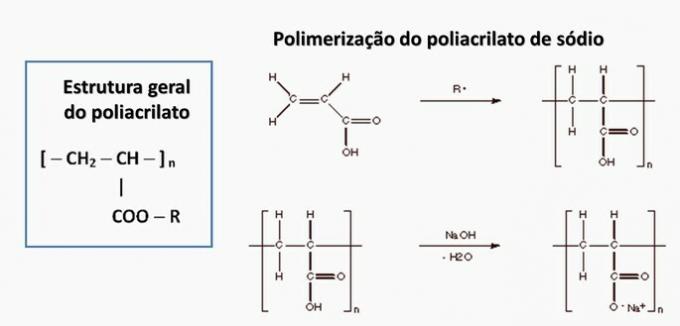
e) FAUX. Le polypropylène est formé lors de la polymérisation du monomère de propylène.
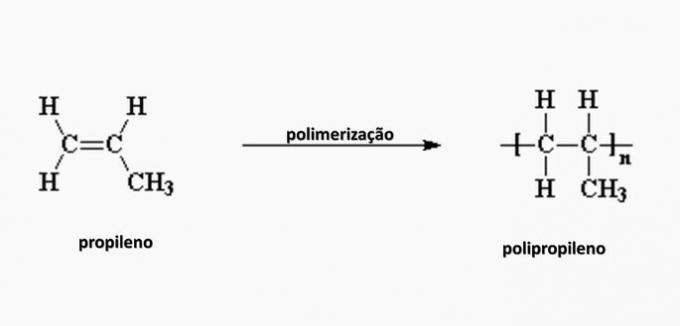
question 4
(Enem/2008) La Chine s'est engagée à indemniser la Russie pour le déversement de benzène d'une industrie Pétrochimie chinoise dans la rivière Songhua, un affluent de la rivière Amour, qui fait partie de la frontière entre les deux des pays. Le président de l'Agence fédérale des ressources en eau de Russie a assuré que le benzène n'atteindrait pas les pipelines de l'eau potable, mais a demandé à la population de faire bouillir l'eau courante et d'éviter de pêcher dans le fleuve Amour et ses affluents. Les autorités locales stockent des centaines de tonnes de charbon, car le minéral est considéré comme un absorbeur de benzène efficace. Internet: (avec adaptations). Compte tenu des mesures adoptées pour minimiser les dommages causés à l'environnement et à la population, il est correct d'affirmer que
a) le charbon, lorsqu'il est placé dans l'eau, réagit avec le benzène, l'éliminant.
b) le benzène est plus volatil que l'eau et doit donc être bouilli.
c) l'orientation pour éviter la pêche est due à la nécessité de conserver le poisson.
d) le benzène ne contaminerait pas les canalisations d'eau potable, car il serait naturellement décanté au fond de la rivière.
e) la pollution causée par le déversement de benzène de l'industrie chinoise serait limitée à la rivière Songhua.
Alternative correcte: b) le benzène est plus volatil que l'eau et il est donc nécessaire de le faire bouillir.
Un tort. Le charbon contient dans sa structure plusieurs pores et est utilisé comme adsorbant, car il est capable d'interagir avec les contaminants et de les retenir à sa surface, mais pas de les éliminer.
b) CORRECT. Plus la volatilité d'une substance est grande, plus elle passe facilement à l'état gazeux. Alors que le point d'ébullition de l'eau est de 100°C, celui du benzène est de 80,1°C. En effet, l'eau est un composé polaire et le benzène est un composé non polaire.
Les types d'interactions que font les molécules sont différents et affectent également le point d'ébullition des substances. La molécule d'eau est capable de faire des liaisons hydrogène, un type d'interaction beaucoup plus forte que celle que le benzène, avec le dipôle induit, est capable de faire.
c) FAUX. Dans une chaîne alimentaire, un être devient la nourriture d'un autre en fonction des interactions des espèces dans un lieu. Lorsqu'une substance toxique est rejetée dans un environnement, il y a accumulation progressive et les poissons contaminés, lorsqu'ils sont ingérés par l'homme, peuvent emporter du benzène avec eux et provoquer des mutations de l'ADN et même même le cancer.
d) FAUX. Le benzène a une densité inférieure à celle de l'eau. Ainsi, la tendance est que même sous l'eau, il continue de se propager.
e) FAUX. Les changements saisonniers peuvent encore aggraver le problème, car les basses températures diminuent la capacité de décomposition biologique des produits chimiques par l'action du soleil ou des bactéries.
question 5
(Enem/2019) Les hydrocarbures sont des molécules organiques avec une série d'applications industrielles. Par exemple, ils sont présents en grande quantité dans diverses coupes pétrolières et sont généralement séparés par distillation fractionnée en fonction de leur température d'ébullition. Le tableau présente les principales fractions obtenues lors de la distillation du pétrole à différentes plages de température.
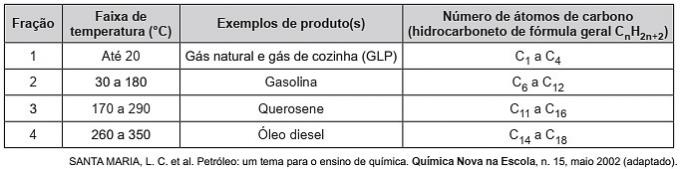
Dans la fraction 4, la séparation des composés se produit à des températures plus élevées car
a) leurs densités sont plus grandes.
b) le nombre de branches est supérieur.
c) sa solubilité dans l'huile est plus grande.
d) les forces intermoléculaires sont plus intenses.
e) la chaîne carbonée est plus difficile à rompre.
Alternative correcte: d) les forces intermoléculaires sont plus intenses.
Les hydrocarbures interagissent par dipôle induit et ce type de force intermoléculaire s'intensifie avec l'augmentation de la chaîne carbonée.
Par conséquent, les coupes pétrolières les plus lourdes ont une température d'ébullition plus élevée, car les chaînes interagissent plus fortement par un dipôle induit.
Pour plus d'exercices, avec résolution commentée, voir aussi :
- Exercices sur les Hydrocarbures
- Exercices sur les fonctions organiques
- Questions de chimie à Enem

