Les sulfates sont des composés ioniques qui contiennent l'anion SO42-, qui est appelé l'anion sulfate.
Le soufre est un élément de la famille 16 ou VI-A, ce qui signifie qu'il a 6 électrons dans sa couche de valence. Selon la règle de l'octet, il lui faudrait 2 électrons de plus pour avoir 8 électrons dans la dernière couche électronique et ainsi être stable. Mais le soufre subit une expansion d'octet, car c'est un élément situé dans la troisième période du tableau Périodique, étant relativement grand, ce qui lui permet d'accueillir plus de huit électrons à son environ.
Ainsi, comme on peut le voir ci-dessous, le niveau de valence du soufre se dilate pour abriter un total de 12 électrons. Mais deux atomes d'oxygène ne sont toujours pas stables, chacun avec sept électrons dans la couche de valence, nécessitant ainsi de recevoir un électron de plus pour se stabiliser. Pour cette raison, la charge de chacun de ces deux atomes est de -1, ce qui donne une charge totale pour l'anion de -2 :
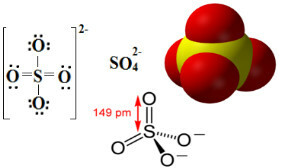
L'anion sulfate peut provenir de l'acide sulfurique (H2SEUL4(aq)) indiqué ci-dessous:
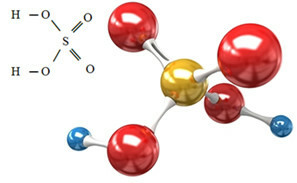
L'acide sulfurique réagit avec une base, dans une réaction de neutralisation, formant un sel inorganique, qui est notre sulfate, et aussi de l'eau :
Réaction générique: Acide sulfurique + Base → Sel (sulfate) + Eau
H2SEUL4 + 2 ÇOh →Ç2SEUL4+ 2H2O
Voir un exemple ci-dessous où le sulfate de potassium est formé :
H2SEUL4 + 2 KOH →K2SEUL4+ 2H2O
A noter que la nomenclature d'un sulfate se fait simplement par la règle : sulfate + nom de l'élément qui s'y rattache. De plus, les formules des sulfates sont faites en échangeant la charge de chaque ion contre l'indice de l'élément, l'indice "1" n'ayant pas besoin d'être écrit :
Exemples:
À+1 SEUL42- → À2SEUL4→ sulfate de sodium
mg+2 SEUL42- → MgSO44→ sulfate de magnésium
Ici+2 SEUL42- → Cas4→ sulfate de calcium
Ba+2 SEUL42- → BASO4→ sulfate de baryum
Al+3 SEUL42- → Al2(SEUL4)3→ sulfate d'aluminium
Les sels contenant l'ion sulfate sont généralement solubles dans l'eau, à quatre exceptions près: le sulfate de calcium (CaSO4), sulfate de strontium (SrSO4), sulfate de baryum (BaSO4) et sulfate de plomb (PbSO4). C'est parce qu'il y a une haute énergie de liaison entre ces cations (Ca2+, Monsieur2+, Ba2+ et Pb2+) et le sulfate, puisqu'ils ont tous une charge +2 et l'anion sulfate a une charge -2. Ainsi, rompre cette connexion devient plus difficile.
Les sulfates se présentent sous forme de réseaux cristallins, en raison de l'attraction que des charges opposées exercent les unes sur les autres, comme indiqué ci-dessous dans le cas du sulfate de cuivre (CuSO4):

Les sulfates se trouvent dans la nature principalement sous forme de minéraux. Voir quelques exemples :
barytine → sulfate de baryum;
Gypse → sulfate de calcium;
Célestite → sulfate de strontium;
anglesid'accord → sulfate de plomb;
Glaubérite → sulfate double de calcium et de sodium: CaNa2(SEUL4)2;
Alun de potassium (kalinite) → sulfate d'aluminium et de potassium double hydraté: KAl (SO4)2.11H2O
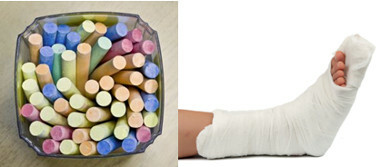
Parmi les principaux sulfates de la vie courante, nous avons le sulfate de calcium, qui sous forme anhydre (sans eau) est utilisé dans la fabrication de la craie scolaire. Lorsqu'il est sous forme dihydratée, (CaSO4 .2h2O), il est connu sous le nom de gypse et est plus abondant. Lors du chauffage, il forme du sulfate de calcium hémihydraté (CaSO4. ½H2O), qui est du plâtre, utilisé dans l'orthopédie, les moules dentaires, la construction civile et les peintures.
Un autre sel important est le ssulfate de magnésium (MgSO44), connu sous le nom de samer al ou sel d'Epsom, qui a une action laxative et est utilisé pour les massages et les bains relaxants.
Par Jennifer Fogaça
Diplômé en Chimie
