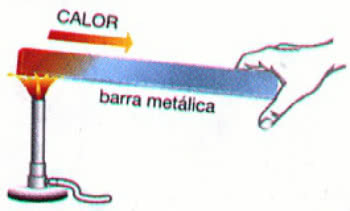
La cinétique chimique étudie la vitesse des réactions chimiques et les facteurs qui influencent la vitesse de ces réactions.
Utilisez les questions ci-dessous pour tester vos connaissances et consulter les commentaires sur les résolutions.
question 1
En ce qui concerne les facteurs qui influencent la vitesse d'une réaction chimique, il n'est PAS CORRECT d'affirmer que :
a) Plus la concentration de réactifs est élevée, plus la réaction est rapide.
b) Plus la surface de contact est grande, plus la vitesse de réaction est grande.
c) Plus la pression est élevée, plus la réaction est rapide.
d) Plus la température est élevée, plus la réaction est rapide.
e) La présence d'un catalyseur maintient la vitesse de réaction constante.
Alternative incorrecte: e) La présence d'un catalyseur maintient la vitesse de réaction constante.
Les catalyseurs augmentent la vitesse de réaction, car ils facilitent la formation du complexe activé entre les réactifs.
Ainsi, les catalyseurs créent un mécanisme plus court pour que la réaction se développe, entraînant une augmentation de la vitesse.
question 2
Selon _____________, des collisions efficaces doivent se produire entre les réactifs pour la formation des produits. De plus, il y a suffisamment de ___________ pour rompre les liaisons chimiques des réactifs et former un ___________, qui est un état intermédiaire avant la formation des produits.
Les mots qui remplissent correctement les blancs sont respectivement :
a) enthalpie, énergie cinétique et variation du catalyseur.
b) théorie des collisions, énergie d'activation et complexe activé.
c) vitesse de réaction, enthalpie et inhibiteur.
d) pression partielle, entropie et substrat.
Alternative correcte: b) théorie de collision, énergie d'activation et complexe activé.
Selon la théorie des collisions, les collisions entre les réactifs sont nécessaires pour qu'une réaction chimique se produise. Pour cela, les substances doivent être dans une position favorable pour que les chocs soient efficaces.
L'énergie d'activation agit comme une barrière énergétique qui doit être surmontée pour rompre les liaisons des composés réactifs. Plus l'énergie d'activation est faible, plus la réaction est rapide.
Le complexe activé est une espèce intermédiaire instable formée avant les produits.
question 3
Les quatre déclarations suivantes sont faites au sujet des catalyseurs :
JE. Un catalyseur fonctionne en augmentant la vitesse d'une réaction, mais il ne modifie pas ses performances.
II. Dans une réaction chimique, le catalyseur n'est pas consommé dans le chemin de réaction.
III. Les catalyseurs créent une voie alternative pour transformer les réactifs en produits. Pour cela, une plus grande énergie d'activation est nécessaire.
IV. Le catalyseur n'est capable d'accélérer la réaction que dans le sens direct.
Les options qui présentent des informations correctes sur les catalyseurs sont :
a) I et II
b) II et III
c) I et IV
d) Tout
Alternative correcte: a) I et II.
Les catalyseurs sont utilisés pour accélérer les réactions chimiques. La réaction utilisant le catalyseur ne modifie pas son rendement, c'est-à-dire que la quantité attendue de produit est produite, mais en moins de temps.
Les catalyseurs ne sont pas consommés pendant la réaction chimique, ils aident à la formation du complexe activé. Par conséquent, un catalyseur peut être récupéré à la fin de la réaction chimique.
Les catalyseurs sont capables de réduire le temps de réaction en créant un mécanisme alternatif pour la formation de produits avec une énergie d'activation plus faible. Par conséquent, la réaction se produit plus rapidement.
Les catalyseurs agissent à la fois dans le sens direct et dans le sens inverse de la réaction.
question 4
La rapidité avec laquelle une réaction chimique a lieu dépend de :
JE. Nombre de collisions effectives entre réactifs.
II. Assez d'énergie pour réarranger les atomes.
III. Orientation favorable des molécules.
IV. Formation d'un complexe activé.
a) I et II
b) II et IV
c) I, II et III
d) I, II, III et IV
Alternative correcte: d) I, II, III et IV.
Des collisions efficaces se produisent lorsque les réactifs sont dans des positions favorables aux chocs, ce qui favorisera le réarrangement des atomes.
L'énergie d'activation doit être suffisante pour que la collision entre les réactifs entraîne la rupture des liaisons et la formation du complexe activé.
Toutes les collisions entre les particules en réaction ne provoquent pas la réaction. L'orientation avec laquelle la collision se produit est importante pour que la formation des produits se produise.
Le complexe activé est un état intermédiaire et instable avant la formation de produits. Il est créé lorsque l'énergie d'activation de la réaction est dépassée.
question 5
Le dioxyde de carbone est un gaz formé par la réaction entre le monoxyde de carbone et l'oxygène gazeux, selon l'équation chimique ci-dessous.
CO(g) + ½ le2(g) → CO2(g)
Sachant qu'en 5 minutes de réaction 2,5 mol de CO ont été consommées, quelle est la vitesse de développement de la réaction en fonction de la consommation d'O2?
a) 0,2 mol. min-1
b) 1,5 mol. min-1
c) 2,0 moles. min-1
d) 0,25 mole. min-1
Alternative correcte: d) 0,25 mol. min-1
Pour répondre à cette question, nous devons examiner l'équation chimique.
CO(g) + ½ le2(g) → CO2(g)
Notez que 1 mole de monoxyde de carbone réagit avec ½ mole d'oxygène pour former 1 mole de dioxyde de carbone.
La quantité indiquée dans la déclaration se réfère au monoxyde de carbone, mais la réponse doit être en termes d'oxygène. Pour cela, nous devons effectuer une règle de trois et trouver la quantité d'oxygène.
1 mol CO - ½ mol O2
2,5 mol CO - x d'O2
x = 1,25 mole
Nous appliquons maintenant les valeurs de la formule pour la vitesse de développement de la réaction.
Par conséquent, la vitesse de développement de la réaction par rapport à l'oxygène est de 0,25 mol.min-1.
question 6
Notez la représentation graphique du développement d'une réaction chimique hypothétique, qui relie l'énergie et le chemin de réaction.
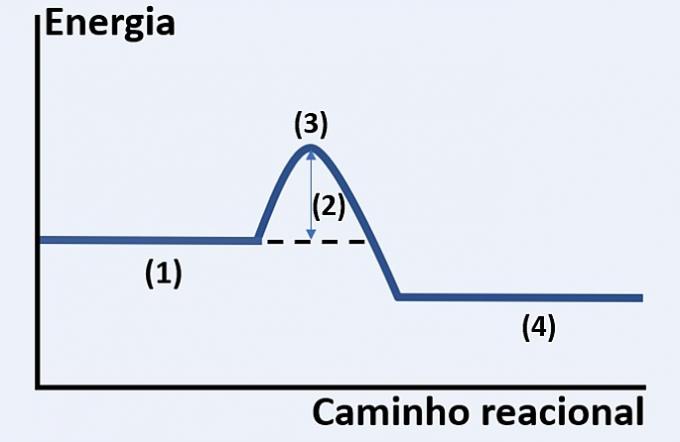
Vérifiez l'alternative qui remplace correctement (1), (2), (3) et (4), respectivement.
a) substrats, chaleur dégagée, état d'énergie maximale et fin de réaction.
b) réactifs, énergie d'activation, complexe activé et produits.
c) réactifs, énergie cinétique, catalyseur et substrats.
d) réactifs, chaleur absorbée, énergie thermique et produits.
Alternative correcte: b) réactifs, énergie d'activation, complexe activé et produits.
Le graphique montré est celui d'une réaction endothermique, c'est-à-dire qu'il y a une absorption d'énergie pour que la réaction se produise.
Toi réactifs (1) sont au début du graphique et les énergie d'activation (2) correspond à la différence entre l'énergie stockée dans les réactifs et dans le complexe activé (3). Enfin, après avoir passé l'état intermédiaire, la formation de des produits (4).
Par conséquent, les réactifs doivent surmonter l'énergie d'activation pour réorganiser leurs atomes en une structure intermédiaire appelée complexe activé afin que les produits se forment.
question 7
La substance A est capable de se décomposer et de devenir la substance B. Observez le développement de cette réaction dans l'image ci-dessous.

Concernant la vitesse de réaction, on peut dire que :
a) La substance A se décompose entre 0 et 15 s à une vitesse de 0,35 mol.s-1.
b) La substance A se décompose entre 15 et 30 s à la vitesse de 0,02 mol.s-1.
c) La substance A se décompose entre 0 et 15 s à la vitesse de 0,04 mol.s-1.
d) La substance A se décompose entre 15 et 30 s à la vitesse de 0,03 mol.s-1.
Alternative correcte: d) La substance A se décompose entre 15 et 30 s à la vitesse de 0,03 mol.s-1.
Le taux de décomposition de la substance A peut être calculé par la formule :
Calculons la vitesse de réaction en termes de substance A entre les intervalles donnés.
Plage entre 0 et 15 :
Plage entre 15 et 30 :
Par conséquent, l'alternative d est correcte, car la substance A se décompose entre 15 et 30 s à une vitesse de 0,03 mol.s.-1.
question 8
Considérez la réaction hypothétique suivante.
aA + bB → cC + dD
Notez la variation de la concentration de A et C ci-dessous.
| Fois) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Consommation de A (mol/L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Formation de C (mol/L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Sur la base des informations fournies dans la question, quel est, respectivement, le taux de consommation de A et le taux de formation de C dans l'intervalle entre 5 et 25 min ?
a) 0,3 mole. L-1.s-1 et 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 et 0,3 mol. L-1.s-1
c) - 0,25 mole. L-1.s-1 et 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 et 0,3 mol. L-1.s-1
Alternative correcte: c) - 0,25 mol. L-1.s-1 et 0,1 mol. L-1.s-1.
Un taux de consommation :
C taux de formation :
Ainsi, dans la réaction, A est consommé à raison de 0,25 mol.s-1, sa valeur est donc négative, tandis que B se forme à raison de 0,1 mol. L-1.s-1.
Lire aussi:
- Cinétique chimique
- thermochimie
- Équilibre chimique
- Réactions chimiques