O Diagramme de phases est un graphique qui vous permet de définir dans quel état physique se trouve une substance à un moment donné, en connaissant sa température et sa pression.
Les mesures en laboratoire sont utilisées pour construire le diagramme de phase d'une substance donnée.
Le diagramme est divisé en trois régions, qui représentent l'état solide, liquide et vapeur.
Les points sur les lignes qui délimitent ces régions indiquent les valeurs de température et de pression que la substance peut être dans deux états.
Un diagramme de phase comprend les éléments suivants :
- courbe de La fusion: sépare les zones correspondant aux états solide et liquide.
- courbe de vaporisation: sépare les zones correspondant aux phases liquide et vapeur.
- courbe de sublimation: sépare les zones correspondant aux phases solide et vapeur.
- point triple: point d'intersection des trois courbes (fusion, vaporisation et sublimation). Ce point indique les valeurs de température et de pression que la substance peut être simultanément dans les trois états.
- Point critique: indique la température la plus élevée à laquelle la substance est de la vapeur. A partir de ce moment, il n'est plus possible de différencier les états liquide et vapeur. À des températures supérieures au point critique, la substance devient un gaz.
Dans la figure ci-dessous, nous présentons une représentation d'un diagramme de phases :

Lire la suite sur: Changements d'état physique.
courbe de fusion
Les substances, en général, augmentent de volume lorsqu'elles subissent une fusion et, au contraire, diminuent de volume lorsqu'elles se solidifient. En conséquence, une augmentation de la pression entraîne une augmentation du point de fusion (température de fusion).
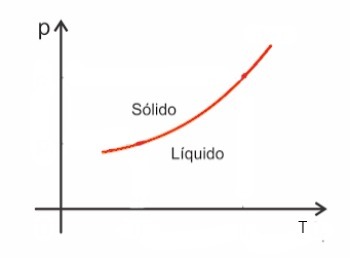
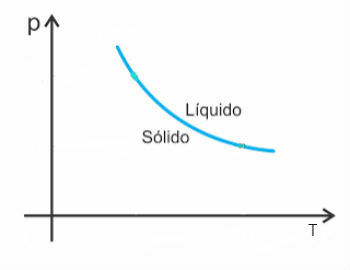
Cependant, il y a quelques exceptions parmi eux l'eau, qui en fondant diminue de volume. Dans ce cas, une augmentation de la pression provoque une diminution du point de fusion.
Ainsi, la courbe de fusion de ces substances ressemblera à ceci :
Exemple
Considérez le diagramme de phase du CO2 (dioxyde de carbone) représenté ci-dessous et répondez aux questions :
a) De quelle phase est le CO2 , quand sa température est de -60 ºC et la pression de 50 atm ?
b) Une certaine quantité de CO2 le liquide est soumis à une pression de 56 atm, et est confiné dans un récipient. Si le liquide est chauffé, en maintenant la pression constante, quelle est la valeur de température à laquelle la vaporisation se produira ?
c) Quelle est la valeur de température et de pression du point triple du CO2?
d) Un morceau de glace carbonique (CO2) est soumis à une pression de 2 atm. Il est chauffé en maintenant une pression constante. A un certain moment, un changement de phase commence à se produire. Quel est le nom de ce changement ?
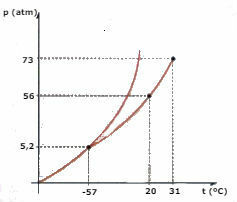
Résolution:
a) En observant le diagramme, nous concluons que le CO2 sera en phase solide.
b) La vaporisation se produira lorsque la température atteint 20°C.
c) Le point triple correspond à l'intersection des trois courbes, dans le cas de CO2, lorsqu'il a une température de -57°C et une pression de 5,2 atm, les trois états physiques peuvent coexister.
d) La sublimation se produira
Pour en savoir plus, lisez aussi :
- Solidification
- Point de fusion et d'ébullition
- Évaporation
- Condensation
Exercices résolus
1) Enem - 2000
Aujourd'hui encore, il est très fréquent que les gens utilisent des récipients en terre cuite (pots ou pots en céramique non émaillés) pour conserver l'eau à une température inférieure à celle de l'environnement. Ceci est dû au fait:
a) l'argile isole l'eau de l'environnement, la maintenant toujours à une température inférieure à la sienne, comme s'il s'agissait de polystyrène.
b) l'argile a le pouvoir de « geler » l'eau en raison de sa composition chimique. Dans la réaction, l'eau perd de la chaleur.
c) l'argile est poreuse, laissant passer l'eau. Une partie de cette eau s'évapore en prélevant de la chaleur sur le moringa et le reste de l'eau, qui sont ensuite refroidis.
d) l'argile est poreuse, permettant à l'eau de se déposer à l'extérieur de la cruche. L'eau extérieure est toujours à une température plus élevée que l'intérieur.
e) Le Moringa est une sorte de réfrigérateur naturel, libérant des substances hygroscopiques qui réduisent naturellement la température de l'eau.
Alternative c: l'argile est poreuse, laissant passer l'eau. Une partie de cette eau s'évapore en prélevant de la chaleur sur le moringa et le reste de l'eau, qui sont ensuite refroidis.
2) Ita - 2013
Considérons le diagramme de phase hypothétique représenté schématiquement dans la figure suivante :

Que représentent les points A, B, C, D et E ?
point A: point de sublimation
point B: point triple
Point C: point de fusion/solidification
point D: point de vaporisation/condensation
point E: point critique
3) UECE - 2009
En regardant le diagramme de phase PT ci-dessous. On peut conclure, à juste titre, qu'une substance qui est passée par le processus de sublimation suit la trajectoire :

a) X ou Y
b) O ou U
c) U ou V
d) T ou X
Alternative b: Y ou U



