L'équilibre thermique, également appelé équilibre thermodynamique, se produit lorsque deux corps ou substances atteignent le même température.
Ce concept de thermodynamique est lié au transfert de chaleur spontané (énergie thermique) qui se produit entre deux corps en contact.
Dans ce processus, le corps plus chaud transfère la chaleur au corps plus froid jusqu'à ce que les deux soient à la même température.

schéma de transfert de chaleur
L'échange d'énergie entre deux corps (énergie thermique) entraîne la perte d'énergie thermique du corps plus chaud et le gain d'énergie du corps plus froid.
Exemple
A titre d'exemple, on peut citer le mélange de café chaud avec du lait froid. Bien qu'ils aient des températures initiales différentes, en peu de temps le corps le plus chaud (café) transfère de l'énergie thermique au plus froid (lait). Ainsi, le mélange devient tiède en raison de l'équilibre thermique.
En supposant que le café était à 50°C et le lait à 20°C, l'équilibre thermique est atteint lorsque les deux sont à 35°C.

propagation de la chaleur
Il est important de noter que la chaleur est l'échange d'énergie et son transfert peut se produire de trois manières :
- conduction thermique: augmentation de l'énergie cinétique ;
- convection thermique: création de courants de convection ;
- rayonnement thermique: au moyen d'ondes électromagnétiques.
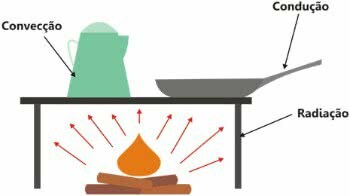
Types de propagation de la chaleur
Lire la suite: propagation de la chaleur.
Formule
Pour calculer le bilan thermique, la formule suivante est utilisée :
Q1 + Q2 + Q3... = 0 ou alors Q=0
Étant,
Q: quantité de chaleur (température corporelle)
Ainsi, nous savons que la somme de toutes les énergies thermiques est nulle.
O chaleur sensible elle est liée à la variation de température des corps. Il est calculé par la formule suivante :
Q = m. ç. Δθ
Où,
Q: quantité de chaleur sensible (chaux ou J)
m: masse corporelle (g ou kg)
ç: chaleur spécifique de la substance (cal/g°C ou J/Kg°C)
Δθ: variation de température (°C ou K)
Lisez aussi surCalorimétrieetChaleur et température.
Exercices d'examen d'entrée avec rétroaction
1. (Mackenzie) Quand on mélange 1,0 kg d'eau (chaleur spécifique sensible = 1,0 cal/g°C) à 70°C avec 2,0 kg d'eau à 10°C, on obtient 3,0 kg d'eau à :
a) 10°C
b) 20°C
c) 30°C
d) 40°C
e) 50°C
Alternative c) 30°C
2. (UFP-RS) Considérez les déclarations suivantes :
JE. Lorsque deux corps sont en équilibre thermique, ils ont tous deux la même quantité de chaleur.
II. Lorsque deux corps sont en équilibre thermique, ils ont tous deux la même température.
III. La chaleur est le transfert de température d'un corps à un autre.
IV. La chaleur est une forme d'énergie en transit.
D'après les déclarations ci-dessus, on peut dire que :
a) I, II, III et IV sont corrects
b) I, II, III sont corrects
c) I, II et IV sont corrects
d) II et IV sont corrects
e) II et III sont corrects
Alternative d) II et IV sont corrects
3. (FATEC-SP) Un système A est en équilibre thermique avec un autre B et celui-ci n'est pas en équilibre thermique avec un autre C. Alors, on peut dire que :
a) les systèmes A et C ont la même quantité de chaleur.
b) la température de A est différente de celle de B.
c) les systèmes A et B ont la même température.
d) la température de B est différente de celle de C, mais C peut avoir la même température que dans le système A.
e) aucune de ces réponses.
Alternative c) les systèmes A et B ont la même température.
4. (UFV-MG) Lorsque deux corps de matériaux différents sont en équilibre thermique, isolés de l'environnement, on peut dire que :
a) le plus chaud est celui qui a le moins de masse.
b) malgré le contact, leurs températures ne varient pas.
c) le plus chaud fournit de la chaleur au plus froid.
d) le plus froid fournit de la chaleur au plus chaud
e) leurs températures dépendent de leurs densités.
Alternative b) malgré le contact, leurs températures ne varient pas.
5. (UFScar-SP) Deux corps A et B, de masses mLES dansB, sont initialement à des températures tLES et toiB, respectivement, avec tLES tB. A un instant donné, ils sont mis en contact thermique. Après avoir atteint l'équilibre thermique, nous aurons :
a) t'a > t'b
b) t'a c) t'a = t'b
d) s.d.a.
Alternative c) t'a = t'b
Voir aussi la définition deÉquilibre en physique.


