Hybridation du carbone de type sp2 il se produit lorsqu'il a une double liaison et deux liaisons simples ou une liaison pi (π) et trois liaisons sigma (σ). En fait, l'hybridation sp2 elle se produit entre les atomes qui établissent la double liaison.
Un exemple d'une telle molécule est le formaldéhyde (CH2O). Notez sa structure ci-dessous :
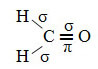
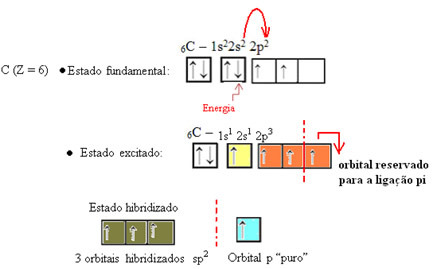
Comme on le voit dans le texte "hybridation de type sp3», l'hybridation du carbone se produit lorsqu'un électron du sous-niveau 2 reçoit de l'énergie et est « transporté » vers le sous-niveau 2p et, ainsi, à l'origine de 4 orbitales hybridées à partir du "mélange" d'orbitales atomiques pur.
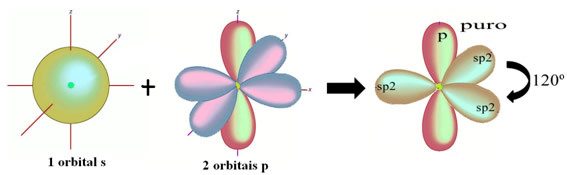
Dans le cas du formaldéhyde, on sait qu'il y aura une liaison pi, donc une de ces orbitales hybridées est réservée à cette liaison, tandis que les trois autres portent les liaisons sigma :
Les atomes d'hydrogène qui font la liaison simple avec le carbone, la font avec leur orbitale s :
L'orbitale p "pure" restante lie l'atome d'oxygène et la molécule de formaldéhyde a la structure suivante :
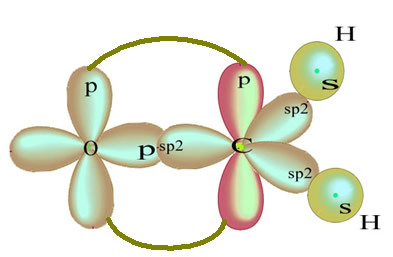
Quant au type de liaisons existant dans cette structure formaldéhyde, on a :

Connexions: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm
