Analyse volumétrique ou volumétrie c'est un procédure de laboratoire dans laquelle nous utilisons un certain volume d'un solution dans concentration connu pour déterminer la concentration d'une autre solution. Le volume de la solution de concentration connue sera déterminé lorsqu'elle réagit complètement avec la solution de concentration inconnue, c'est-à-dire que les solutions impliquées doivent réagir entre elles.
Les instruments les plus utilisés pour mesurer un volume donné sont :
- Pipette

Exemple de pipette utilisée en mesure de volume
- Burette

La burette est un équipement de mesure volumétrique important
La mesure du volume se fait en évaluant la hauteur de ce qu'on appelle le ménisque, qui n'est autre que la zone superficielle du liquide, qui présente un aspect rectangulaire ou bombé (forme de goutte), selon l'épaisseur du récipient. Plus le récipient est large, plus le ménisque est rectangulaire; plus le récipient est fin, plus il sera convexe. Pour évaluer le ménisque, l'œil doit être exactement à sa hauteur et il faut prendre comme référence la région inférieure, si le ménisque est rectangulaire, ou la pointe, si renflée. Voir une représentation d'une évaluation :
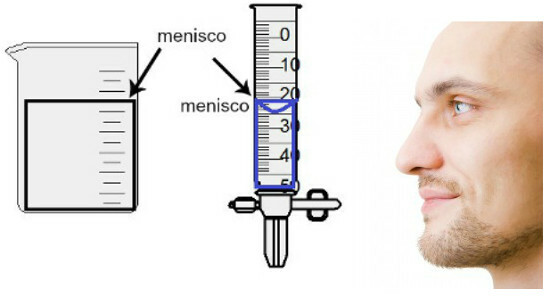
Pour évaluer un ménisque, il est important que vos yeux soient tournés vers lui.
En analyse volumétrique, l'équipement le plus utilisé est la burette. En effet, comme la méthode implique des réactions chimiques et que celles-ci peuvent être traitées rapidement, la burette permet le liquide est libéré à son extrémité en gouttes, ce qui nous permet d'empêcher le liquide de sortir plus contrôlé.
L'une des procédures les plus utilisées en volumétrie est la titrage. C'est une analyse volumétrique qui implique l'occurrence d'une réaction entre un acide et une base ou vice versa. Le matériel nécessaire à sa réalisation est représenté dans l'image ci-dessous :
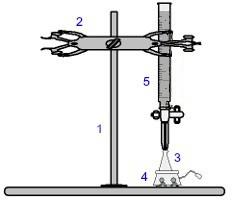
Représentation de l'équipement utilisé dans un titrage
Les chiffres en bleu signifient :
1) Prise en charge universelle ;
2) Griffe (utilisée pour tenir la burette);
3) Erlenmeyer (reçoit la solution de concentration inconnue);
4) Agitateur magnétique (utilisé pour agiter la solution présente dans l'erlenmeyer) ;
5) Burette (reçoit la solution de concentration connue).
Un volume de la solution de concentration inconnue avec l'indicateur de phénolphtaléine est ajouté dans l'erlenmeyer (la solution deviendra immédiatement rose). Dans la burette, un certain volume de la solution de concentration connue est placé. Ensuite, la solution acide de la burette est directement versée goutte à goutte dans la solution basique dans l'erlenmeyer. Ce goutte-à-goutte dure jusqu'à ce que la solution de base devienne incolore, moment auquel nous appelons le point de retournement, ce qui indique que toute la base présente dans la solution a complètement réagi avec l'acide.
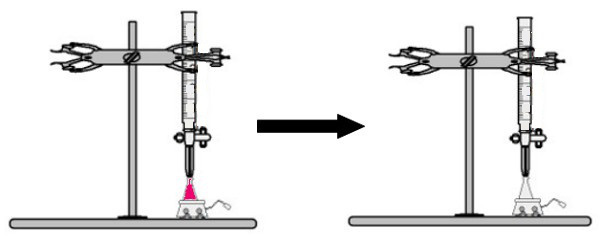
Au tournant, la solution n'est plus rose et devient incolore
Observation: Si la solution de concentration inconnue est acide, lorsqu'elle recevra l'indicateur de phénolphtaléine, elle sera incolore. Ainsi, le tournant du titrage sera le moment où la solution acide virera au rose lors de la réception de la solution basique de la burette.
Enfin, pour déterminer la concentration de la solution basique, il suffit d'utiliser l'équation suivante :
Ma.Va = Mb.Vb
Ma = molarité acide;
Va = volume d'acide ;
Mb = molarité de base ;
Vb = volume de base.
Suivez maintenant un exemple de la façon dont le calcul d'une solution avec une molarité inconnue est effectué.
1er) 30 mL d'une solution de base inconnue ont été ajoutés à un erlenmeyer afin d'effectuer un titrage pour déterminer sa concentration (molarité). Dans la burette ont été ajoutés 50 ml d'une solution acide de concentration 0,2 mol/L. Après avoir laissé tomber la solution acide et jusqu'à ce que la solution basique ait été titrée, il a été observé que 20 ml de la solution acide ont été utilisés dans le titrage. Déterminer la molarité de la solution de base utilisée.
Données de l'exercice :
Vb = 30 ml
Mo = ?
Ma = 0,2 mol/L
Va = 20 ml
Comme la molarité de l'acide et son volume sont respectivement de 0,2 mol/L et 20 mL, et le volume de la base utilisée est de 30 mL, il suffit d'utiliser la formule de titrage :
Ma.Va = Mb.Vb
0.2.20 = Mo.30
4 = Mo.30
4 = Mo
30
Mo = 0,133 mol/L
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm

