La troisième loi de la thermodynamique traite du comportement de la matière avec une entropie proche de zéro.
Selon cette loi, chaque fois qu'un système est en équilibre thermodynamique, son entropie tend vers zéro.
La deuxième loi de la thermodynamique concerne l'entropie. Par la suite, la troisième loi apparaît comme une tenter d'établir un point de référence absolu qui détermine l'entropie.
Walther Nernst (1864-1941) était le physicien qui a traité les principes qui ont formé la base de la troisième loi de la thermodynamique.
Selon Nernst, l'entropie aurait tendance à avoir une valeur minimale si la température d'une substance pure était égale ou proche du zéro absolu.
Pour cela, Nernst a proposé la formule ci-dessous, qui montre que la variation d'entropie (ΔS) et de température (T) tendent vers des valeurs minimales, c'est-à-dire 0 :
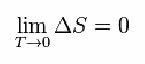
Mais qu'est-ce que l'entropie ?
Entropie c'est la façon dont les molécules s'organisent dans le système. Cette organisation se traduit en désordre, non pas au sens de confusion, mais au sens de mouvement et d'agitation des molécules.
Plus les molécules peuvent bouger, plus elles sont désorganisées, plus elles ont d'entropie.
Initialement, Nernst a suggéré que l'entropie qu'il proposait ne serait possible que sur des cristaux parfaits.
Enfin, il a conclu que la température égale au zéro absolu n'existait pas, ce qui fait de la troisième loi une loi controversée.
Ainsi, pour de nombreux physiciens, ce n'est pas une loi mais une règle.
Après tant d'années (depuis 1912), les scientifiques tentent d'obtenir cette température ou des températures qui se rapprochent de plus en plus du zéro absolu. Ainsi, ils ont découvert que cela n'est possible que dans les gaz, en écartant toute substance à l'état solide ou liquide.
A lire aussi :
- Loi zéro de la thermodynamique
- Première loi de la thermodynamique
- Deuxième loi de la thermodynamique
- Exercices sur la thermodynamique