La tension superficielle est un phénomène qui se produit à la surface de liquides, tels que l'eau, formant un film mince.
Lorsque l'eau, à l'état liquide, occupe un récipient, on peut percevoir la séparation entre le liquide et l'environnement. En effet, l'interaction entre les molécules d'eau à la surface est différente des interactions à l'intérieur du liquide.
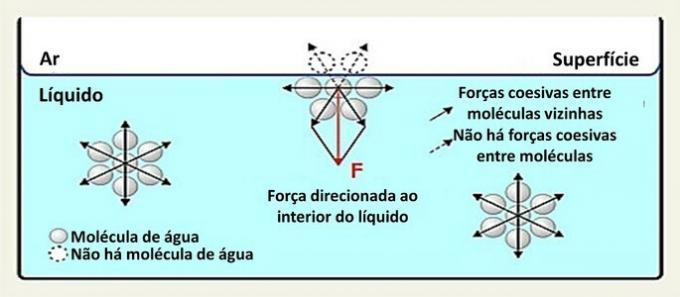
À la surface, une molécule d'eau interagit avec des molécules sur les côtés et en dessous. À l'intérieur, une molécule est entourée d'autres molécules et il y a interaction dans toutes les directions par des liaisons hydrogène.
C'est à cause de cette propriété que l'on observe le phénomène de formation d'une gouttelette. Pour cette raison, il est également possible pour les insectes de marcher sur l'eau.
Qu'est-ce que la tension superficielle ?
C'est la formation d'un film mince sous un liquide dû à l'inégalité des attractions entre les molécules qui le composent. Ce phénomène se produit plus nettement dans les liquides qui ont forces intermoléculaires intense, comme l'eau.
Les interactions entre les espèces dans un liquide sont appelées forces de cohésion. Alors que les molécules à l'intérieur d'un liquide sont attirées par les molécules voisines dans toutes les directions, les molécules à la surface interagissent avec les molécules en dessous et à côté d'elles.
Voyez comment se produit la tension superficielle dans l'eau.
L'eau (H2O) est une molécule polaire formée de 2 atomes d'hydrogène (pôles positifs) et d'un atome d'oxygène (pôle négatif) réunis par des liaisons covalentes. Le pôle positif d'une molécule est attiré par le pôle négatif de la molécule voisine, formant des liaisons hydrogène.
Ce type d'interaction au sein du liquide est réparti dans toutes les directions. En surface, les forces sont dirigées vers le bas et latéralement, car au-dessus d'elles, il n'y a pas de molécules d'eau. Cela rend les molécules de surface plus cohésives et crée un film élastique.
L'unité de tension superficielle est donnée par le quotient entre l'unité de force et l'unité de longueur, les plus adoptées étant dyne/centimètre (dyne/cm) et newton/mètre (N/m).
L'eau a une tension superficielle élevée, dont la valeur est de 72,75 dyne/cm. Cependant, le mercure, un métal liquide, a une tension superficielle environ 7 fois supérieure à celle de l'eau, 475 dyne/cm.
Vouloir en savoir davantage? Alors regardez les textes suivants:
- Propriétés de l'eau
- Molécules polaires et apolaires
- Liaisons chimiques
Phénomènes causés par la tension superficielle
La tension superficielle est responsable de certains phénomènes que nous observons dans la vie de tous les jours. Les principaux sont :
Animaux qui marchent sur l'eau

Les insectes, araignées et autres animaux peuvent marcher ou se reposer sur le L'eau car aux extrémités de ses pattes il y a des poils enduits d'une substance graisseuse et, par conséquent, ils ne peuvent pas pénétrer entre les molécules d'eau qui sont jointes à la surface.
Formation de gouttelettes d'eau

Les gouttelettes d'eau sont sphériques en raison de la contraction de la molécules de la surface causée par la tension superficielle. La sphère se produit parce que c'est la forme géométrique dans laquelle il y a la plus petite relation entre la surface et le volume. Par conséquent, la forme sphérique maintient le moins de molécules d'eau en contact avec l'air.
Exercices sur la tension superficielle de l'eau
1. Un tensioactif est une substance qui agit sur une autre pour changer :
a) Osmolarité.
b) Tension superficielle.
c) Électrophorèse.
d) Viscosité.
e) Pression osmotique.
Alternative correcte: b) Tension superficielle.
Un tort. L'osmolarité est liée à la quantité de particules de soluté contenues dans un volume donné de solvant.
b) CORRECT. Les détergents et les savons abaissent la tension superficielle de l'eau et sont généralement appelés tensioactifs, car les molécules de ces matériaux se placent entre les molécules d'eau et réduisent la tension superficiel.
c) FAUX. L'électrophorèse est une technique de séparation des molécules en fonction de leurs charges.
d) FAUX. La viscosité est une propriété physique qui détermine la résistance d'un fluide à l'écoulement.
e) FAUX. La pression osmotique est une propriété colligative qui correspond à la pression qui doit être exercée sur un système pour empêcher l'osmose de se produire spontanément.
En savoir plus sur les problèmes abordés dans ce numéro:
- Propriétés de la matière
- Propriétés colligatives
- Pression osmotique
2. La tension superficielle des liquides dépend directement des processus d'interaction entre les molécules, comme les liaisons hydrogène par exemple. Laquelle des substances ci-dessous a la tension superficielle la plus élevée ?
a) benzène
b) octane
c) alcool éthylique
d) tétrachlorure de carbone
e) acide éthanoïque
Alternative correcte: e) acide éthanoïque.
Un tort. Le benzène est un hydrocarbure, une molécule non polaire, et ne fait pas de liaisons hydrogène.
b) FAUX. L'octane est un hydrocarbure et, par conséquent, c'est une molécule non polaire qui ne fait pas de liaisons hydrogène.
c) FAUX. L'alcool éthylique est un composé légèrement polaire qui peut former des liaisons hydrogène, mais l'interaction entre les molécules est limitée.
d) FAUX. Le tétrachlorure de carbone est un composé organique non polaire et ne fait donc pas de liaisons hydrogène.
e) CORRECT. Le groupe fonctionnel acide carboxylique (-COOH) peut établir des liaisons hydrogène avec l'oxygène ou l'hydrogène hydroxyle.

En savoir plus sur les problèmes abordés dans ce numéro:
- Polarité des molécules
- Fonctions organiques
- Hydrocarbures
expérience de tension superficielle
Regardez la vidéo ci-dessous avec une expérience qui démontre la tension superficielle de l'eau.