La sublimation est le passage de l'état solide à l'état gazeux et inversement, sans passer par l'état liquide.
Pour qu'une substance subisse le processus de sublimation, elle doit être soumise à certaines valeurs de température et de pression.
Boules à mites et CO2 solide (glace sèche) sont des exemples de substances qui subissent une sublimation dans des conditions ambiantes.

Diagramme de phases
On peut découvrir l'état physique d'une substance en connaissant les valeurs de température et de pression auxquelles elle est soumise.
Pour cela, nous utilisons des diagrammes construits pour chaque substance, à partir de valeurs trouvées expérimentalement.
Appelé "Diagramme de phases", il est divisé en trois régions qui représentent les états solide, liquide et gazeux. Les lignes qui délimitent ces régions signalent les points auxquels la substance change de phase.
Le point triple dans le diagramme indique la température et la pression auxquelles la substance peut coexister dans les trois phases. En dessous de ce point se trouve la courbe de sublimation.
Les points sur cette courbe déterminent les valeurs de pression et de température auxquelles la sublimation se produira.
Lorsqu'un solide est soumis à une pression inférieure au point triple, s'il est chauffé, il passera directement à l'état gazeux.
Le passage de l'état solide direct à l'état gazeux peut également se produire en diminuant la pression lorsque sa température est inférieure à celle du point triple.
En savoir plus sur: Changements d'état physique.
Diagramme de phase du dioxyde de carbone (CO)2 )
Le point triple du CO2 se produit lorsque la pression est de 5 atm. Ce fait justifie qu'il soit courant de voir l'apparition de sublimation dans la neige carbonique, puisque la pression ambiante est de 1 atmosphère.
Pour cette raison, le dioxyde de carbone liquide n'est pas obtenu dans les conditions ambiantes. Dans ces conditions, il est soit à l'état solide, soit à l'état vapeur.
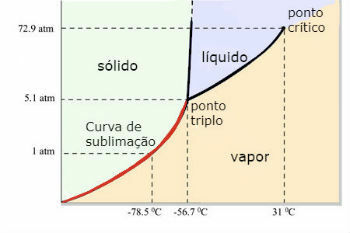
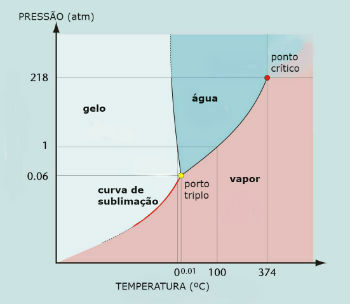
Diagramme des phases de l'eau (H2O)
Le point triple de l'eau se produit lorsque la pression n'est que de 0,06 atm. Ainsi, dans des conditions ambiantes, il n'est pas courant que l'eau se sublime.
Pour en savoir plus, lisez aussi :
- États physiques de l'eau
- États physiques de la matière
- Liquéfaction ou condensation
- Propriétés de la matière
- Solidification
- La fusion
- Vaporisation
- Ébullition
- Évaporation



