Comme expliqué dans le texte "Théorie du phlogistique», on a longtemps cru que cette théorie fournissait l'explication du phénomène de combustion. Elle a dit ça les matériaux combustibles avaient un principe inflammable commun présent uniquement en eux, qui est devenu connu sous le nom de phlogistique. Si une matière n'a pas brûlé, c'est parce qu'elle n'aurait pas de phlogistique dans sa composition.
Cependant, certains scientifiques ont commencé à être en désaccord avec cette conclusion, car il existe également plusieurs contradictions dans cette théorie, les expériences menées ont apporté d'autres preuves, qui n'existaient pas auparavant, qui ont conduit ces études à une autre direction.
Un scientifique qui a excellé dans ces études de combustion était Antoine Laurent Lavoisier (1743-1794). L'une de ses expériences les plus célèbres consistait à placer, dans une cornue, un échantillon soigneusement pesé de mercure métallique et introduire le tube de cornue dans un dôme ou une cuve en verre contenant de l'air et également du mercure dans son base.
Il a chauffé cette cornue avec du mercure à travers un four, la faisant calciner. Lavoisier a observé qu'au fur et à mesure que la réaction se déroulait, une poudre rouge, l'oxyde de mercure II, se formait sur les parois de la cornue. le volume de mercure dans la cuve augmentait. Cela signifiait que le volume d'air diminuait au fur et à mesure qu'il était remplacé par du mercure., comme le montre la figure ci-dessous. En pesant le système initial et final, Lavoisier a vu que la masse n'avait pas changé.

Ainsi, Lavoisier a conclu que la combustion ne s'est pas produite en raison de la présence d'un mystérieux phlogistique, mais oui car le mercure ou tout autre matériau combustible a réagi avec un autre élément présent dans l'air.
Au même moment, le scientifique anglais Joseph Priestley montra à Lavoisier qu'il avait découvert une sorte d'« air », qu'il appela "air déphlogistiqué". Grâce à ses propres expériences, Lavoisier a pu produire cet air et a réalisé d'autres expériences avec lui.
Par exemple, il a placé une cuve en verre sur une bougie allumée dans une bouée d'eau. Il remarqua qu'à mesure que la bougie s'éteignait, l'eau montait. Et lorsque l'eau atteignit le cinquième de son volume, la bougie s'éteignit complètement. La conclusion était la suivante :
(1er) L'eau est montée parce que la bougie consommait l'air ;
(2e) L'« air déphlogistiqué » n'était pas tout l'air atmosphérique, mais la cinquième partie de celui-ci.
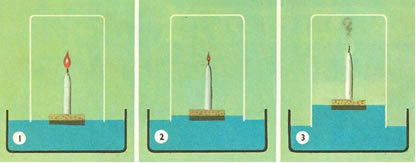
Ainsi, Lavoisier trouva que cet air était mêlé à tout l'air atmosphérique et qu'il était nécessaire à la combustion; sans elle, la combustion n'a pas eu lieu. Lavoisier fut même le premier à faire une détermination expérimentale de la composition de l'air, arrivant au résultat de 21 % d'oxygène et 79 % d'un autre composant, qu'il a appelé azote, un « type d'air » qui ne participait pas à la la combustion. Aujourd'hui, nous savons que c'était de l'azote gazeux.
Initialement, il appela l'air déphlogistiqué le "air respirable" puis changé en "air vital".Ce n'est qu'en 1778 que Lavoisier décide de nommer « l'air vital » l'oxygène (mot qui vient du grec oxy, qui signifie « acide »; et gén, « générateur ou produit »). Il lui donna ce nom car jusqu'alors ses expériences l'avaient amené à la conclusion que ce nouveau gaz était présent dans tous les acides; ce qui s'est avéré plus tard être une mauvaise conclusion, le nom est toujours resté.
Jusque-là, l'oxygène n'était pas considéré comme un élément chimique, tel que nous le connaissons aujourd'hui, car à cette époque il n'y avait pas encore de définition concise d'un élément.
Carl Wilhelm Scheele a été le premier à isoler l'oxygène, cependant, il n'a pas vu l'importance de la découverte à laquelle il est parvenu car elle était encore très liée à la théorie du phlogistique. C'est Lavoisier qui a interprété et montré le rôle de l'oxygène dans la combustion.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/descoberta-oxigenio.htm
