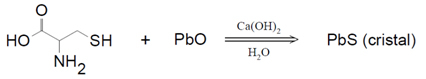Les réactions organiques sont des réactions qui ont lieu entre des composés organiques. Il existe plusieurs types de réactions, qui se produisent en cassant des molécules donnant lieu à de nouvelles liaisons.
Largement utilisés dans l'industrie, c'est à partir d'eux que peuvent être fabriqués les médicaments et les produits cosmétiques, les plastiques, entre autres.
le principal types de réactions organiques elles sont:
- réaction d'addition
- réaction de remplacement
- réaction d'élimination
- Réaction d'oxydation
Réaction d'addition
La réaction d'addition a lieu lorsque les liaisons de la molécule organique se rompent et qu'un réactif y est ajouté.
Il se produit principalement dans les composés dont les chaînes sont ouvertes et qui ont des insaturations, comme les alcènes () et des alcynes (
).
Exemples de réactions d'addition
Exemple 1: hydrogénation (ajout d'hydrogène)
L'hydrogénation d'un alcène produit un alcane.
Exemple 2: halogénation (ajout d'halogènes)
L'halogénation d'un alcène produit un halogénure.
Exemple 3: hydratation (ajout d'eau)
L'hydratation d'un alcène produit un alcool.
A lire aussi: Composés organiques
Réaction de remplacement
La réaction de substitution se produit lorsqu'il y a des atomes de liaison (ou un groupe) qui sont remplacés par d'autres.
Il se produit principalement parmi les alcanes, les cyclanes et les aromatiques.
Exemples de réactions de substitution
Exemple 1: halogénation (substitution par halogène)
L'halogénation d'un alcane produit un halogénure.
Exemple 2: nitration (substitution par nitro)
La nitration d'un alcane produit un composé nitro.
Exemple 3: sulfonation (substitution par des sulfoniques)
La sulfonation d'un alcane produit un acide.
A lire aussi: Fonctions organiques
Réaction d'élimination
La réaction d'élimination a lieu lorsqu'un ligand carboné est retiré de la molécule organique.
Cette réaction est contraire à la réaction d'addition.
Exemples de réactions d'élimination
Exemple 1: élimination d'hydrogène (déshydrogénation)
L'élimination de l'hydrogène d'un alcane produit un alcène.
Exemple 2: élimination des halogènes (déshalogénation)
L'élimination des halogènes d'un dihalogénure produit un alcène.
Exemple 3: élimination des halogénures
L'élimination de l'halogénure d'un halogénure produit un alcène.
Exemple 4: élimination de l'eau (déshydratation de l'alcool)
Retirer l'eau d'un alcool produit un alcène.
Voir aussi: estérification
Réaction d'oxydation
La réaction d'oxydation, également appelée redox, a lieu lorsqu'il y a un gain ou une perte d'électrons.
Exemples de réactions d'oxydation
Exemple 1: oxydation énergétique des alcènes
L'oxydation énergétique d'un alcène produit des acides carboxyliques.
Exemple 2: oxydation de l'alcool primaire
L'oxydation énergétique d'un alcool primaire produit de l'acide carboxylique et de l'eau.
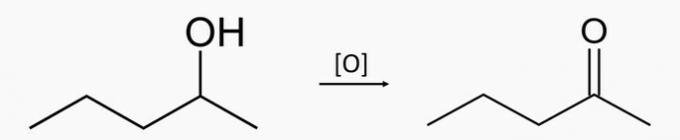
Exemple 3: oxydation secondaire de l'alcool
L'oxydation d'un alcool secondaire produit de la cétone et de l'eau.
A lire aussi: Acides carboxyliques
Exercices sur les réactions organiques
question 1
(Unifesp/2002) De nombreux alcools peuvent être obtenus par hydratation catalysée par un acide d'alcènes.
Dans cette réaction d'addition, le H dans l'eau est ajouté au carbone qui a plus d'hydrogènes attachés et le groupe hydroxyle est attaché au carbone moins hydrogéné (règle de Markovnikov).
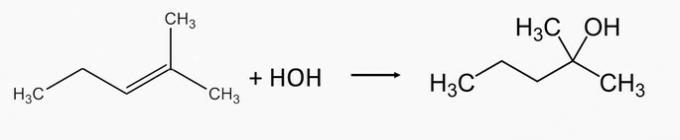
Sachant que les alcools formés lors de l'hydratation de deux alcènes sont respectivement le 2-méthyl-2-pentanol et le 1-éthylcyclopentanol, quels sont les noms des alcènes correspondants qui leur ont donné naissance ?
a) 2-méthyl-2-pentène et 2-éthylcyclopentène.
b) 2-méthyl-2-pentène et 1-éthylcyclopentène.
c) 2-méthyl-3-pentène et 1-éthylcyclopentène.
d) 2-méthyl-1-pentène et 2-éthylcyclopentène.
e) 3-méthyl-2-pentène et 2-éthylcyclopentène.
Alternative correcte: b) 2-méthyl-2-pentène et 1-éthylcyclopentène.
L'alcool 2-méthyl-2-pentanol est produit en hydratant le 2-méthyl-2-pentène alcène.
L'alcool 1-éthylcyclopentanol est généré par l'hydratation du 1-éthylcyclopentène alcène.
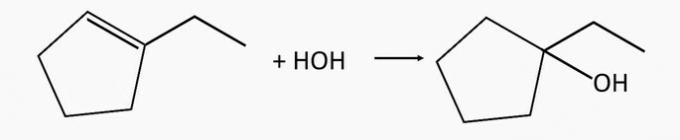
question 2
(Ufal/2000) Dans l'étude de la chimie des composés carbonés, on apprend que le BENZÈNE :
( ) C'est un hydrocarbure.
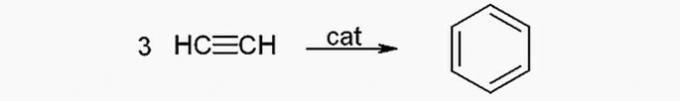
( ) Peut être obtenu à partir d'acétylène.
( ) Dans l'huile, c'est un composant de plus grande proportion massique.
( ) Peut subir une réaction de substitution.
( ) C'est un exemple de structure moléculaire qui présente une résonance.
(VRAI) Le benzène est un hydrocarbure aromatique. Ce composé est formé uniquement d'atomes de carbone et d'hydrogène, dont la formule est C6H6.
(VRAI) Le benzène peut être produit à partir de l'acétylène par la réaction suivante :
(FAUX) Le pétrole est un mélange d'hydrocarbures et la masse des composants est liée à la taille de la chaîne. Par conséquent, les chaînes carbonées plus grandes ont une masse plus importante. Les fractions les plus lourdes du pétrole, comme l'asphalte, ont des chaînes de plus de 36 atomes de carbone.
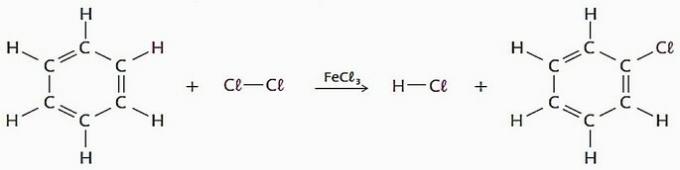
(VRAI) Les réactions de substitution utilisant le benzène comme réactif ont de nombreuses applications industrielles, principalement pour la production de médicaments et de solvants.
Dans ce processus, un atome d'hydrogène peut être remplacé par des halogènes, un groupe nitro (-NO2), groupe sulfonique (—SO3H), entre autres.
Voir un exemple de ce type de réaction.
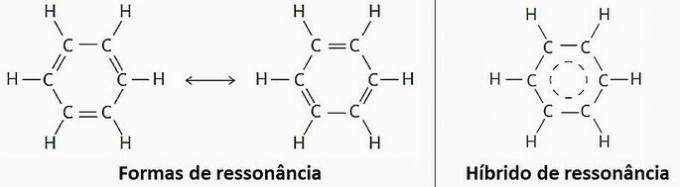
(VRAI) En raison de la résonance, le benzène peut être représenté par deux formules structurelles.
Cependant, en pratique, il a été observé que la longueur et l'énergie des liaisons établies entre les atomes de carbone sont égales. Par conséquent, l'hybride de résonance est le plus proche de la structure réelle.
question 3
(UFV/2002) La réaction d'oxydation d'un alcool de formule moléculaire C5H12O‚ avec KMnO4 fourni un composé de formule moléculaire C5H10O.
Cochez l'option qui montre la CORRECTE corrélation entre le nom de l'alcool et le nom du produit formé.
a) 3-méthylbutan-2-ol, 3-méthylbutanal
b) pentan-3-ol, pentan-3-one
c) pentan-1-ol, pentan-1-one
d) pentane-2-ol, pentanal
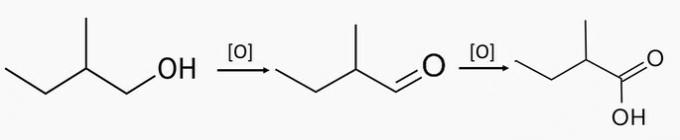
e) 2-méthylbutan-1-ol, 2-méthylbutan-1-one
Alternative correcte: b) pentan-3-ol, pentan-3-one.
Un tort. L'oxydation d'un alcool secondaire produit une cétone. Par conséquent, le produit correct pour l'oxydation du 3-méthylbutan-2-ol est le 3-méthylbutan-2-one.
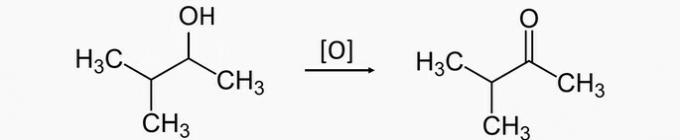
b) CORRECT. L'oxydation de l'alcool secondaire pentan-3-ol produit la cétone pentan-3-one.

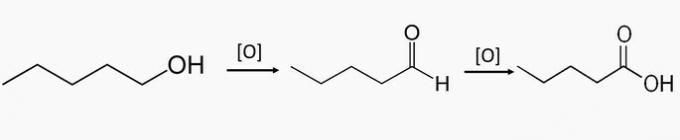
c) FAUX. Ces composés font partie de l'oxydation des alcools primaires, qui produit un aldéhyde ou un acide carboxylique.
Le pentane-1-ol est un alcool primaire et par oxydation partielle du composé, le pentanal peut être formé et par oxydation totale, l'acide pentanoïque est formé.
d) FAUX. L'oxydation de l'alcool secondaire pentan-2-ol produit la cétone pentan-2-one.
e) FAUX. L'alcool primaire 2-méthylbutan-1-ol produit l'aldéhyde 2-méthylbutanal en oxydation partielle et l'acide 2-méthylbutanoïque en oxydation totale.
question 4
(Mackenzie/97) Dans la réaction d'élimination, qui se produit dans le 2-bromobutane avec de l'hydroxyde de potassium en milieu alcoolique, on obtient un mélange de deux composés organiques qui sont des isomères de position.
L'un d'eux, qui se forme en moindre quantité, est le 1-butène. L'autre est le :
a) le méthylpropène.
b) 1-butanol.
c) butane.
d) cyclobutane.
e) 2-butène.
Alternative correcte: e) 2-butène.
Les alcènes sont produits par la réaction de l'halogénure organique HBr avec l'hydroxyde de potassium KOH, en présence d'alcool éthylique comme solvant.

Différents composés se sont formés en raison de la présence de l'atome d'halogène au milieu de la chaîne carbonée, générant plus d'une possibilité d'élimination.
Cependant, bien qu'il existe deux possibilités de produits, ils n'auront pas les mêmes quantités formées.
Le 2-butène, pour cette réaction, se formera en plus grande quantité, car il provient de l'élimination d'un carbone tertiaire. Le 1-butène s'est formé à partir de l'élimination d'un carbone primaire et, par conséquent, une plus petite quantité s'est formée.