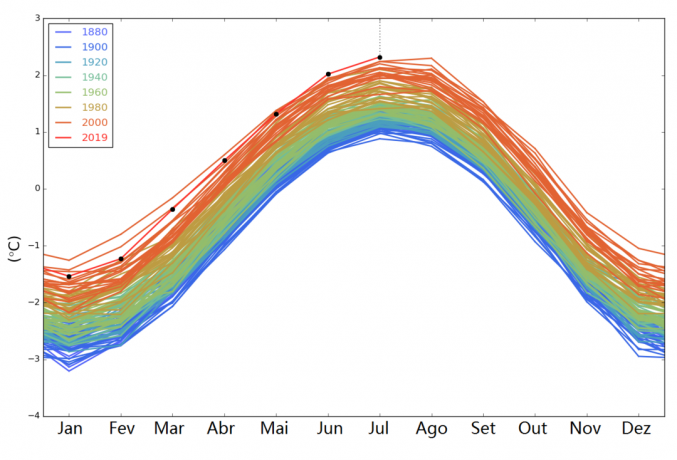
La densité est une grandeur physique qui mesure la concentration de matière d'un corps dans un volume donné.
Il est obtenu par le rapport entre la masse corporelle et le volume et se mesure en kg/m3 dans le Système international d'unités (SI).
La densité d'un corps est inversement proportionnelle à son volume, c'est-à-dire que plus le volume est grand, plus la densité est faible. Notez cette relation dans la formule de densité :

La densité est la propriété qui détermine si un corps flottera ou coulera dans un liquide. Si le matériau est moins dense que le liquide, il flottera, mais s'il a une densité plus élevée que le liquide, il coulera.
Tous les matériaux trouvés dans la nature ont une densité qui peut être mesurée. La densité dépend de la Type de materiel, de état physique où il se trouve et les conditions de Température et pression environnementale.
Comment calculer la densité ?
Pour calculer la densité d'une substance ou d'un mélange de substances, divisez la masse corporelle par son volume, selon la formule :
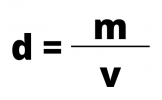
Où:
- d = densité mesurée en kg/m3, g/cm3 ou g/ml
- m = masse mesurée en kg ou g
- v = volume mesuré en m3, cm3 ou ml
Il est important de garder à l'esprit que lorsque le volume d'un corps change dans différentes conditions de température et de pression, la densité sera différente lorsque la température et la pression changent.
Par exemple, l'eau a une densité d'environ 1 g/cm3 dans des conditions ambiantes, mais lorsqu'il devient de la glace sa densité diminue à 0,92 g/cm3 - c'est à cause de cette différence de densité que la glace flotte sur l'eau.
 La glace flotte sur l'eau car sa densité est plus faible à l'état solide qu'à l'état liquide.
La glace flotte sur l'eau car sa densité est plus faible à l'état solide qu'à l'état liquide.
Exemples pratiques de densité
Pour comprendre en pratique ce qu'est la densité, imaginez deux contenants, l'un avec 1 kg de plomb et l'autre avec 1 kg de coton. Les deux ont la même masse, soit 1 kilo.
Cependant, comme le coton est beaucoup plus léger que le plomb, une quantité beaucoup plus importante de ce matériau est nécessaire pour que les masses des deux récipients s'égalisent.
Ainsi, l'espace occupé par le coton sera beaucoup plus grand que l'espace occupé par le plomb. Cela signifie que le plomb a une quantité de matière concentrée beaucoup plus importante et donc une densité plus élevée que le coton.
Voyons maintenant d'autres exemples de situations pratiques qui s'expliquent par la différence de densité des matériaux :
Glaçons
Placés dans un verre d'eau, les glaçons flottent car leur densité (0,92 g/cm)3) est inférieure à la densité de l'eau (1g/cm3).
Lorsque les glaçons sont placés dans un verre d'alcool, les glaçons vont couler car leur densité (0,92 g/cm)3) est supérieure à la densité de l'éthanol (0,79 g/cm3).
 La glace coule dans un verre de boisson alcoolisée car la densité de l'alcool est inférieure à celle de l'eau.
La glace coule dans un verre de boisson alcoolisée car la densité de l'alcool est inférieure à celle de l'eau.
Styromousse et clou
Un autre exemple qui aide à comprendre la densité est d'observer le comportement d'un panneau de polystyrène et d'un clou en acier lorsqu'ils sont placés dans l'eau.
L'ongle s'enfonce immédiatement car sa densité (0,78 g/m)3) est bien supérieure à la densité de l'eau. Cela signifie que l'acier a une grande quantité de matière concentrée dans un petit volume.
D'autre part, lorsque le panneau de polystyrène est placé dans l'eau, il flotte car la densité de la mousse de polystyrène est inférieure à la densité de l'eau. Contrairement à l'acier, la mousse de polystyrène est une substance qui a peu de matière concentrée.
 La densité de la mousse de polystyrène est inférieure à celle de l'eau, de sorte que la planche flotte.
La densité de la mousse de polystyrène est inférieure à celle de l'eau, de sorte que la planche flotte.
Masse et densité spécifiques
La densité est également utilisée pour désigner la densité, mais ils ne peuvent pas toujours être compris comme des synonymes.
LES densité fait référence à un corps, qui peut être composé d'une seule substance ou d'un mélange de substances, comme une solution d'eau avec du sucre.
LES Masse spécifique, à son tour, fait référence à la densité d'un substance homogène spécifiques, comme l'aluminium, le plomb ou l'eau.
Cela signifie que lorsqu'un corps est composé d'une seule substance, sa densité est donnée par sa masse spécifique. Cependant, lorsque le corps est hétérogène, il sera nécessaire de calculer sa densité comme le rapport de la masse au volume.
Densité de la substance
Voir la densité (ou masse spécifique) de certaines substances dans le tableau ci-dessous :
| Substance | Densité |
|---|---|
| L'eau | 1,0 |
| Air | 1,2 |
| Acier | 7,8 |
| Aluminium | 2,7 |
| Conduire | 11,3 |
| Cuivre | 8,9 |
| Éthanol | 0,79 |
| Le fer | 7,86 |
| Glace | 0,92 |
| Lait | 1,03 |
| bois | 0,5 |
| Or | 19,3 |
Densité absolue et densité relative
La densité absolue fait référence à la densité d'un corps ou d'une substance donnée. La densité relative, à son tour, est la densité d'un matériau par rapport à un autre.
Le calcul de la densité relative est le rapport entre les deux densités, qui sont calculées en divisant la masse par le volume. La formule de densité peut être exprimée par :
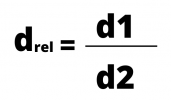
ou alors
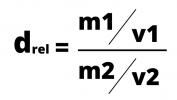
La densité relative est souvent utilisée pour comparer la densité des substances par rapport à l'eau, dont la densité est de 1g/cm3.
Unité de mesure de la densité
L'unité de mesure utilisée dans le Système International (SI) est le kg/m3, mais il est courant de trouver cette grandeur également exprimée en g/cm3 et g/ml. La relation entre ces unités de mesure est :
1 g/cm3 = 1 g/ml = 1000 kg/m3
Voir aussi la signification de chimie et mesures de volume.