Le chimiste français Joseph Louis Proust (1754-1826) a commencé à effectuer des expériences minutieuses concernant les masses des composants de certaines réactions.
Par exemple, les éléments qui composent l'eau sont l'hydrogène et l'oxygène. Proust a découvert que dans cette réaction de formation d'eau, l'hydrogène réagissait toujours avec l'oxygène dans un rapport constant et défini, qui était respectivement de 1:8. Voyez comment cela se passe ci-dessous :

Remarquerez que quelle que soit la masse des éléments utilisés, la proportion sera toujours la même.
Proust a noté que ce n'était pas seulement le cas avec l'eau, mais avec toutes les autres substances.
15,06 g de sulfure cuivrique (CuS) sont formés, par exemple, en faisant réagir 10,00 g de cuivre métallique (Cu) avec 5,06 g de soufre (S). Donc, si on double la quantité de cuivre (qui passera à 20,0 g), et si on veut que tout le cuivre réagisse, il faudra aussi doubler la quantité de soufre, à 10,12 g, avec la formation totale de 30,12 g de sulfure.
Maintenant, si on ajoute une quantité qui n'est pas proportionnelle, l'excédent sera laissé, il ne réagira pas. Notez ceci ci-dessous :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
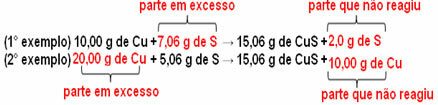
Remarquerez que la réaction n'a lieu que selon la proportion définie. Ainsi, en 1799, Proust conclut que, lorsque plusieurs substances se combinent pour former un composé, cela se fait toujours dans une relation de masse définie.
Il a donc créé une loi qui s'appelle La loi de Proust, Loi des proportions constantes ou alors Loi des proportions définies, qui s'énonce comme suit :

Cette loi et la La loi de Lavoisier (Loi de conservation de masse) sont nommés Lois de poids, parce qu'ils parlent dans des masses de substances impliquées.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Loi de Proust ou loi des proportions constantes »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Consulté le 27 juin 2021.