Le numéro atomique, symbolisé par la lettre Z, correspond à la quantité de protons existant dans le noyau de l'atome d'un élément chimique donné. Par exemple, le numéro atomique de l'hydrogène est 1, ce qui signifie qu'il n'a qu'un proton dans son noyau atomique.
Le numéro atomique apparaît généralement à côté du symbole de l'indice de l'élément chimique (dans le coin inférieur) sur la gauche. Exemple: 1H.
Dans l'état fondamental, le numéro atomique est égal au nombre d'électrons, car dans cet état l'élément est neutre, par conséquent, la quantité de charges positives (protons) doit être égale à la quantité de charges négatives (électrons) du atome.
Le numéro atomique est important car c'est lui qui détermine les principales caractéristiques et propriétés de l'élément, ainsi que son comportement et sa localisation dans le tableau périodique. Les éléments sont répertoriés dans le tableau périodique par ordre croissant de numéro atomique, qui apparaît généralement au-dessus de l'élément, comme indiqué ci-dessous. Notez que le premier élément est l'hydrogène, H (Z = 1), suivi de l'hélium, He (Z = 2), puis vient le lithium, Li (Z = 3), et ainsi de suite.
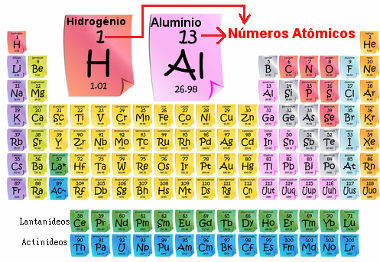
Nombre atomique d'éléments dans le tableau périodique
On peut même conceptualiser un élément chimique comme étant "un ensemble d'atomes qui ont le même numéro atomique". Ainsi, lorsque nous parlons, par exemple, de l'élément chimique oxygène, nous parlons d'atomes de numéro atomique 8. Ci-dessous, nous avons les atomes des éléments chimiques des périodes 1 et 2 du tableau périodique par ordre croissant de numéro atomique :

Éléments chimiques des périodes 1 et 2 du tableau périodique par ordre croissant de numéro atomique
Les numéros atomiques ont été initialement définis par le physicien anglais Henry Gwyn Jeffreys Moseley (1887-1915), et lors de la réalisation d'expériences impliquant le bombardement de divers éléments chimistes avec des rayons X, il a observé que la racine carrée de la fréquence des rayons X produits par l'émission du noyau atomique était directement proportionnelle au numéro atomique de l'élément du tableau. Périodique. Avec cela, il a conclu que le numéro atomique était lié aux propriétés des atomes car il représentait le nombre de charges positives dans le noyau de chaque atome.
Les liaisons chimiques n'affectent pas le nombre atomique des atomes, car elles n'impliquent que des électrons qui se trouvent dans l'électrosphère. Cependant, les réactions nucléaires impliquent le noyau atomique et, par conséquent, le numéro atomique est également inclus.
Par exemple, lorsque des particules (principalement des neutrons modérés) sont bombardées sur un noyau atomique lourd et instable, ce noyau est brisé et donne naissance à deux noyaux atomiques plus petits, c'est-à-dire avec un plus petit nombre de protons et de neutrons, libérant une quantité colossale de énergie.
La fusion nucléaire, en revanche, est le processus inverse, c'est lorsque deux noyaux petits et légers s'unissent, créant un noyau plus gros et plus stable, libérant une quantité d'énergie encore plus grande.
Ainsi, chaque fois que ces réactions nucléaires se produisent, de nouveaux éléments chimiques apparaissent, car les numéros atomiques des éléments initiaux sont différents des numéros atomiques des éléments finaux. Par exemple, voir ci-dessous que la fission de l'uranium-235 de numéro atomique 92 donne naissance au baryum (Z = 56), au krypton (Z = 36) et à trois neutrons :

Réaction de fission nucléaire de l'uranium-235
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm
