se définit comme hybridation l'union d'orbitales atomiques incomplètes. Une orbitale est classée comme incomplète lorsqu'elle n'a qu'un seul électron à l'intérieur au lieu de deux. Voir une représentation d'une orbitale incomplète et d'une orbitale complète :

Dans l'image A, nous avons une orbitale complète; dans l'image B, une orbitale incomplète.
L'hybridation est un phénomène naturel qui se produit avec certains éléments chimiques, tels que le phosphore, le soufre, le carbone, etc. L'hybridation du carbone permet aux atomes de cet élément d'être capables de faire quatre liaisons chimiques, c'est-à-dire que le carbone ne fait que quatre liaisons après avoir subi le phénomène d'hybridation.
Mais pourquoi le carbone s'hybride-t-il et fait-il quatre liaisons ? Pour comprendre ce phénomène, il faut connaître la distribution électronique de cet élément :
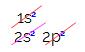
Dans la distribution électronique du carbone, on voit que le sous-niveau 1s est complet (avec deux électrons), le 2s est complet (avec deux électrons) et le sous-niveau 2p est incomplet (le sous-niveau p supporte six électrons, mais il n'y a que deux). En répartissant les électrons 2p de manière représentative, il faut :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
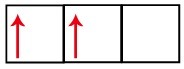
Le sous-niveau p a trois orbitales – dans le cas du carbone, deux d'entre elles sont incomplètes et une est vide. Pour cette raison, cet élément ne doit effectuer que deux liaisons, car le nombre d'orbitales incomplètes détermine toujours le nombre de liaisons.
Cependant, lorsqu'ils reçoivent de l'énergie de l'environnement extérieur, les électrons présents dans le carbone sont excités. Ainsi, l'un des électrons présents dans le sous-niveau 2s se déplace vers l'orbitale du sous-niveau p qui était vide :
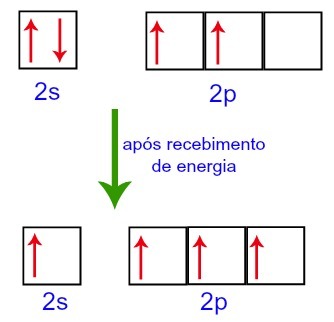
Orbitales de carbone avant et après avoir reçu de l'énergie de l'environnement extérieur
Ainsi, le carbone se retrouve avec quatre orbitales incomplètes dans son deuxième niveau. Ensuite, l'orbitale de sous-niveau 2s rejoint les trois orbitales p, ce qui configure le phénomène de hybridation.
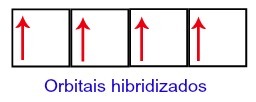
Orbitales de carbone après hybridation
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Hybridation du carbone »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. Consulté le 28 juin 2021.