La loi de Hess a été créée par le chimiste suisse Germain H. Hess (1802-1850), qui est considéré comme l'un des fondateurs de la thermochimie. Sa loi disait :

C'est-à-dire que le ΔH ne dépend que des valeurs d'enthalpie des réactifs et des produits, comme dans l'expression :
| H = ΔHréactifs + Hdes produits |
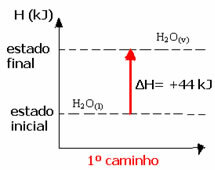
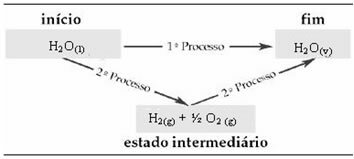
Par exemple, considérons la réaction où 1 mol d'eau (H2O) se transforme en eau à l'état gazeux. Cette réaction est effectuée deux fois; cependant, différentes voies ont été choisies :
(1ère) Elle a été réalisée en une seule étape :
H2O(1) → H2O(v) H= +44 kJ
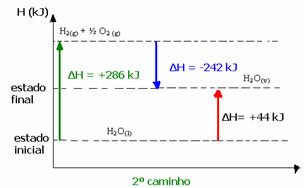
(2e) Elle s'est déroulée en deux étapes :
1ère étape: H2O(1) → H2(g) + ½ le2 (g) H= +286 kJ
2ème étape: H2(g) + ½ le2 (g) → H2O(v) H= -242 kJ
H2O(1) → H2O(v) H= +44 kJ
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Notez que peu importe si une ou deux étapes ont été effectuées, le changement d'enthalpie (ΔH) est toujours de 44 kJ. En effet, ΔH est la somme algébrique des valeurs valoresH des étapes qui composent le processus, c'est-à-dire des processus intermédiaires :
| H = ΔH1 + H2 + H3 + ... |
Par exemple, dans le second cas, le H total de la réaction était la somme du ΔH de la première étape (ΔH= +286 kJ) avec celui de la seconde (ΔH= -242 kJ). Ainsi, nous avons obtenu la même valeur de réaction avec une seule étape :
H = (+286 + (-242)) kJ
H = (+286 -242) kJ
H = +44 kJ
Par conséquent, nous ne nous intéressons qu'aux valeurs initiales et finales. Dans ce cas, l'état initial correspond à H2O(1) et la fin de H2O(v).
Cette loi est devenue très importante en thermochimie, car certaines réactions chimiques ne peuvent pas avoir leur ΔH déterminé expérimentalement. Cependant, selon la loi de Hess, l'enthalpie de ce type de réaction peut être calculée à partir des enthalpies d'autres réactions (réactions intermédiaires).
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Loi de Hess »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Consulté le 28 juin 2021.