La batterie c'est un système dans lequel l'énergie chimique se transforme spontanément en énergie électrique.
En 1836, le chimiste et météorologue anglais John Frederic Daniell (1790-1845) construit une pile différente de celle connue à l'époque: la pile d'Alessandro Volta. Dans ce tas il interconnecté deux électrodes, qui étaient des systèmes constitués d'un métal immergé dans une solution aqueuse d'un sel formé par les cations de ce métal.
L'une des électrodes, l'électrode de cuivre, consistait en une plaque de cuivre trempée dans une solution de sulfate de cuivre (CuSO4). L'autre électrode était une électrode de zinc, constituée d'une plaque de zinc immergée dans une solution de sulfate de zinc (ZnSO4).
Ces deux électrodes étaient reliées entre elles par un circuit électrique qui contenait une lampe, car si elle s'allumait, cela indiquerait l'émergence d'un courant électrique.
De plus, il y avait un pont de sel entre eux. Ce pont était constitué d'un tube de verre en forme de U contenant une solution aqueuse concentrée d'un sel très soluble, tel que le chlorure de potassium (KCl (aq)), par exemple. Les extrémités du tube sont enduites de coton ou d'agar.
Ci-dessous, nous avons la structure de cette cellule ou cellule électrochimique, connue sous le nom de cellule Daniell. Rappelons que chaque électrode est appelée une demi-cellule.
Avec le circuit fermé, la lampe s'allume et après un certain temps, la plaque de zinc est corrodée et a sa masse diminuée, alors que la plaque de cuivre c'est le contraire, sa masse augmente (comme le montre la figure ci-dessous). On note également que il y a une augmentation de la concentration en mol/L des ions Zn2+ et une diminution des ions Cu2+.
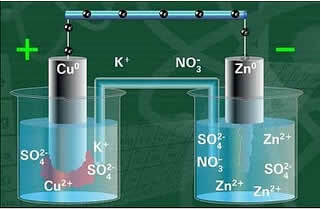
Schéma de pile de Daniell.
Pourquoi cela arrive-t-il?
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Pour comprendre, regardons les réactions qui ont lieu à chaque électrode séparément.
Dans l'électrode de zinc, la réaction d'équilibre suivante se produit :
Zn(s) ↔ Zn2+(ici) + 2 et-
Cela signifie que le zinc métallique (provenant de la plaque) subit une oxydation, c'est-à-dire qu'il donne deux électrons au cation zinc (provenant de la solution) et devient Zn2+. L'inverse se produit également, le cation zinc présent dans la solution reçoit les deux électrons donnés par le zinc et devient du zinc métallique. Par conséquent, il y a un processus ininterrompu d'oxydation et de réduction.
Il en va de même pour l'électrode de cuivre, qui aura la réaction globale en équilibre dynamique: Cu(s) ↔ Cu2+(ici) + 2 et-
Daniell s'est rendu compte que s'il connectait ces deux électrodes, la plus réactive donnerait ses électrons au cation le moins réactif au lieu de le faire avec les cations de sa propre solution. Dans ce cas, le zinc est le plus réactif et subit une oxydation, donnant des électrons au cuivre, d'où la diminution de sa masse. L'électrode qui subit l'oxydation est le pôle négatif, appelé anode. L'électrode de cuivre est celle qui subit la réduction, le cation cuivre reçoit les deux électrons du zinc, et s'appelle la cathode (pôle positif).
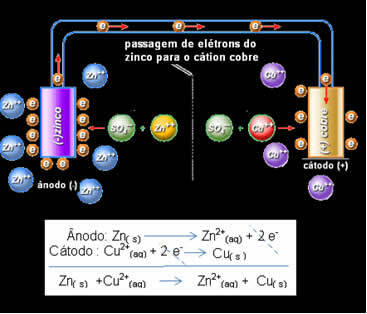
Passage d'électrons et équation globale de la pile de Daniell.
Ci-dessus, nous avons l'équation globale de cet empilement, qui est obtenue en ajoutant les deux demi-réactions. Sa représentation ou notation chimique se fait selon la règle suivante :

Donc pour la pile de Daniell nous avons :
Zn / Zn2+// cul2+ / cul
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
Physico-chimique - Chimie - École du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "La Pile de Danill"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Consulté le 28 juin 2021.
