Pour que vous compreniez le phénomène de ionisation il faut d'abord savoir ce que sont les ions. Notez l'explication ci-dessous :
Chaque atome a le même nombre de protons et d'électrons; par conséquent, chaque atome est électriquement neutre. De plus, les substances formées par des groupes d'atomes ont également un équilibre de charge électrique, étant électriquement neutres.
pourtant, un atome ou un groupe d'atomes peut perdre ou gagner des électrons; lorsque cela se produit, ils perdent leur neutralité et deviennent des ions.
Si l'atome ou le groupe d'atomes perd des électrons, il sera chargé positivement et sera un ion appelé cation. Cependant, si vous gagnez des électrons, la charge sera négative et l'ion sera un anion.
Les substances inorganiques sont ioniques ou ont la capacité de former des ions.
L'un des moyens de former des ions consiste à placer des substances moléculaires dans l'eau, c'est-à-dire formées par des liaisons covalentes, dans lesquelles les électrons sont partagés.
Par exemple, si l'on teste la conduction électrique de l'acide chlorhydrique (HCl) en solution aqueuse (chlorure d'hydrogène dissous dans l'eau), nous verrons que la solution est électrolytique, c'est-à-dire qu'elle conduit un courant électrique, car il y a des ions dans ce solution.

Cela signifie que l'eau a agi comme un réactif, formant des ions à partir d'acide chlorhydrique. Cela se produit selon la réaction ci-dessous :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
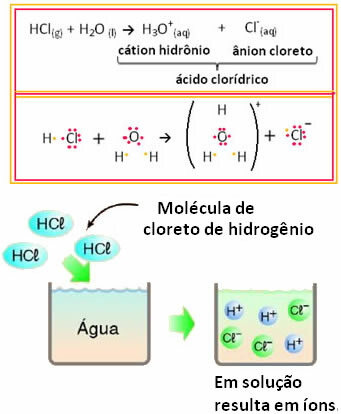
Notez qu'avant de mettre du chlorure d'hydrogène dans l'eau, il n'y avait pas d'ions. Cependant, ses molécules ont réagi avec l'eau et ont formé des ions H positifs3O+ (cations) et négatifs Cl- (anions). Puisque le chlore est plus électronégatif que l'hydrogène, il attire la paire d'électrons de la liaison covalente qui lui est proche et forme l'anion. L'hydrogène, en revanche, est attiré par l'oxygène de l'eau, qui est plus électronégatif que le chlore; et entre l'hydrogène et l'oxygène, une liaison covalente se forme, donnant naissance au cation hydronium. Ce phénomène de formation d'ions est appeléionisation.
Sur la base de l'explication ci-dessus, nous pouvons définir l'ionisation comme suit :

Notez que les ions n'existaient pas avant, car s'ils existaient, comme dans le cas de la dissolution des composés ioniques, nous aurions une dissociation ionique et non une ionisation.
Tous les acides mis en contact avec l'eau subissent une ionisation. Cependant, tous les composés moléculaires ne subissent pas d'ionisation.Par exemple, le sucre (C12H22O11) est moléculaire, cependant, lorsqu'il est placé dans l'eau, aucun ion ne se forme, il se dissout simplement, créant une solution moléculaire non électrolytique, qui ne conduit pas l'électricité.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Ionisation »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Consulté le 28 juin 2021.



