La batterie est un appareil dans lequel un courant électrique est produit à partir d'énergie chimique provenant d'un réaction d'oxydoréduction, c'est-à-dire qu'une espèce du réactif perd des électrons (oxydation), tandis qu'une autre espèce en gagne (réduction).
Voir les représentations des réactions d'oxydation et de réduction qui se produisent dans n'importe quel empilement :
Oxydation: X → et + X+
L'espèce X perd un électron et se transforme en cation.
Réduction: Oui- + et → O
l'anion Y- gagne des électrons et se transforme en une espèce Y neutre.
Composants de base d'une pile
Les composants de base d'une pile sont :
Anode: électrode négative dans laquelle a lieu la réaction d'oxydation, c'est-à-dire la perte d'électrons ;
Cathode: électrode positive dans laquelle a lieu la réaction de réduction, c'est-à-dire le gain d'électrons ;
Solution électrolytique (pont salin) ou matériau conducteur (comme un barreau de graphite): c'est le moyen par lequel les électrons cédés par l'anode atteignent la cathode.
Les bases du fonctionnement d'une batterie
Le fonctionnement d'une pile se produit à partir des événements suivants :
1er principe : Oxydation des anodes
Le métal dans l'anode, comme il a une plus grande tendance à perdre des électrons, devient un cation, comme on peut le voir dans l'équation ci-dessous :
Zn → Zn2+ + 2 et
2e principe : réduction cathodique
Les cations qui font partie du matériau présent dans la cathode (nous utiliserons le cuivre comme exemple), lors de la réception les électrons de l'anode se transforment en cuivre métallique, comme on peut le voir dans l'équation mugissement:
Cul2+ + 2e → Cu
premiers tas
a) La batterie d'Alessandro Volta
La pile arrière d'Alessandro (la première pile de l'histoire), assemblée en 1800, était formée de disques métalliques intercalés, comme dans l'image ci-dessous :

Assemblage similaire à Alessandro's Back to your pile
Les disques étaient entrelacés car ils avaient une composition différente. L'un était en zinc métallique et l'autre en cuivre, toujours séparé par du coton imbibé de saumure (une solution formée d'eau et de sel).
B) Le tas de Daniell
La pile de Daniell, assemblée en 1836, était constituée de deux demi-cellules reliées par un fil conducteur et un pont de sel.
Demi-cellule 1: c'était l'anode, c'est-à-dire le pôle négatif de la batterie.
Il était composé d'une plaque de zinc, et une partie de cette plaque était immergée dans une solution formée d'eau et de sulfate de zinc (ZnSO4).
Demi-cellule 2 : c'était la cathode, c'est-à-dire le pôle positif de la pile.
Il était composé d'une plaque de cuivre, et une partie de cette plaque était immergée dans une solution formée d'eau et de sulfate de cuivre (CuSO4).
pont de sel
Tube en forme de U qui contenait une solution formée d'eau et de chlorure de potassium (KCl), qui reliait les deux demi-cellules (zinc et cuivre) et avait une laine de verre aux deux extrémités.
piles actuellement
Il existe actuellement plusieurs modèles de pieux, mais, en général, ils suivent l'aspect suivant :
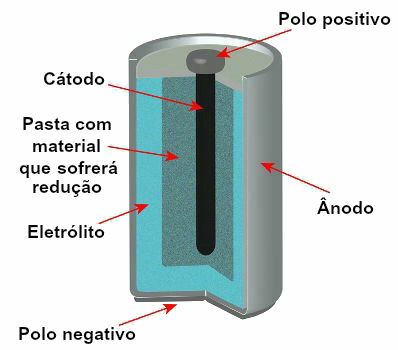
Schéma représentant le modèle d'une pile actuelle
Les modèles les plus utilisés sont la pile dite Leclanché et la pile alcaline, qui présentent les différences suivantes :
Le) Leclanche tas
Il a une anode formée de zinc métallique;
Il a une cathode formée d'une pâte avec du chlorure d'ammonium, de l'eau, de l'amidon et du dioxyde de manganèse ;
Il a une barre de graphite qui sert de conducteur pour les électrons qui partent de la cathode vers l'anode.
B) Pile alcaline
Il a une anode formée de zinc métallique ou de cadmium ;
Il a une cathode formée d'oxyde de mercure, d'oxyde de nickel et d'iode ;
Il doit avoir une base mixte dans le matériau qui constitue la cathode.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm
