Comme le montrent les textes "Spectre électromagnétique des éléments chimiques" et "Spectres d'émission et d'absorption et lois de Kirchhoff», les spectres d'émission discontinus de chaque élément chimique sont différents.

Nous avons donc ci-dessous les spectres distincts de certains de ces éléments :

Ainsi, le physicien danois Niels Böhr (1885-1962) s'est rendu compte que cela pouvait être lié à la structure de l'atome de chacun de ces éléments. Il a donc proposé un modèle atomique qui complétait le modèle de Rutherford, mais se concentrait sur le comportement des électrons environnants dans le noyau de l'atome.
Quelque temps auparavant, Max Planck (1858-1947) avait proposé une théorie selon laquelle les électrons sont quantifié, en ce sens qu'ils émettent et absorbent des quantités spécifiques d'énergie, comme s'il s'agissait de petits paquets d'énergie, qu'il a appelé combien (quantum, au singulier).
Ainsi, Böhr a proposé ce qui suit: puisque chaque élément a un spectre différent, chaque élément a dans son atome des électrons d'énergies constantes et différentes d'un élément à l'autre.
Chaque électron ne peut rester que sur une certaine orbite spécifique, car dans chacune de ces orbites, l'électron a une énergie constante, bien définie et caractéristique. L'électron ne peut occuper que les niveaux d'énergie pour lesquels il a l'énergie respective.
Les spectres sont discontinus car les électrons sont quantifiés.
Un électron ne peut changer de niveau que s'il absorbe de l'énergie. Par exemple, lorsque vous brûlez un sel de sodium dans un bec Bunsen, vous fournissez de l'énergie aux électrons. Lors de l'absorption d'un quantum d'énergie, l'électron saute à un autre niveau plus énergétique, restant dans l'état excité. Cependant, l'état fondamental est plus stable, donc cet électron émet l'énergie absorbée et revient sur son orbite d'origine. Il émet cette énergie sous forme d'ondes électromagnétiques qui peuvent être visualisées sous forme de lumière. Dans le cas du sodium, cette lumière est de couleur jaune intense. Ainsi, lorsque ces ondes traversent un prisme, on obtient le spectre discontinu du sodium.
Ainsi, pour Böhr, chaque ligne lumineuse qui apparaissait dans le spectre discontinu des éléments indiquait l'énergie libérée lorsque l'électron revenait d'un niveau externe à un niveau plus proche du noyau.
La figure ci-dessous permet de mieux comprendre ce problème :
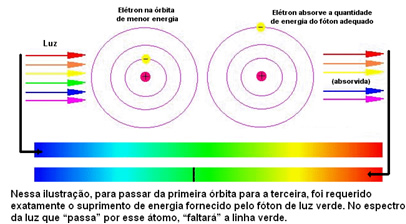
Comme les atomes de chaque élément ne sont autorisés que certaines valeurs d'énergie qui correspondent aux couches d'énergie, pour chaque élément, il existe un spectre différent.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
