LES théorie de l'octet a été proposé par Newton Lewis, qui dans des études a observé que l'interaction atomique se produit de sorte que chaque élément acquiert la stabilité électronique d'un gaz noble, c'est-à-dire huit électrons dans le couche de valence. Cependant, dans certaines molécules, il se produit ce qu'on appelle une expansion ou une contraction de l'octet, c'est-à-dire que l'atome central établit des liaisons plus ou moins prédites.
A lire aussi: Liaison covalente - classifications et caractéristiques
Comment fonctionne la théorie de l'octet ?
Bien sûr, tous les systèmes ont tendance à chercher un moyen de acquérir le plus de stabilité possible, et ce n'est pas différent avec l'atome. Les atomes sont des « particules de base » de toute matière et chacun a une électrosphère dans sa structure. Cette électrosphère a été divisée par Linus Pauling dans les niveaux et sous-niveaux d'énergie. Pauling a développé un diagramme pour montrer à quoi ressemblerait la distribution des électrons autour du noyau d'un atome.
Voir l'image ci-dessous :
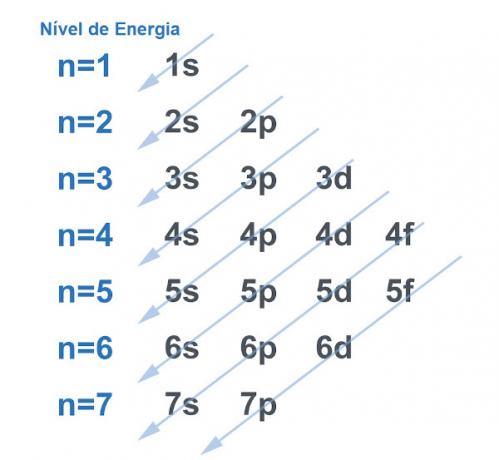
Chaque niveau et sous-niveau contient une quantité de électrons. En faisant une analogie, nous pouvons dire que chaque niveau est une étagère et chaque sous-niveau est une boîte. Dans chaque boîte, placez deux électrons. L'atome est stable lorsque tous ses électrons sont appariés, c'est-à-dire lorsqu'il y a toutes les boîtes de deux électrons chacune.
Exemple:
Faisons la distribution électronique de l'oxygène (O), qui a huit électrons dans son état naturel.
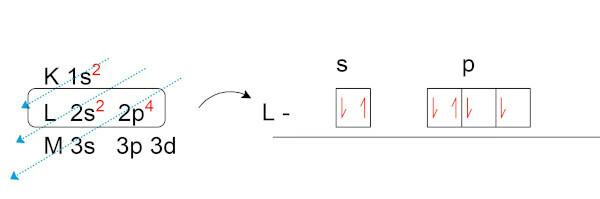
Notez que, dans la couche de valence (la couche L, dans le sous-niveau p), nous avons deux électrons non appariés. Ce sont ces électrons qui établissent des liaisons chimiques avec d'autres éléments cherche à former des paires électroniques.
La théorie de l'octet est basée sur les mathématiques de la sommation des électrons. Si tous les sous-niveaux de la dernière couche électronique ont chacun deux électrons, la couche de valence aura un total de huit électrons et, par conséquent, l'atome sera stable.
A lire aussi: Nombres quantiques - nombres associés à la quantité d'énergie de l'électron
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
gaz nobles
Les gaz nobles sont les seuls éléments qui peut être trouvé dans la nature sous une forme monoatomique, c'est-à-dire sans établir de liaison avec un autre atome. C'est parce qu'ils présentent une stabilité électronique. Presque tous ont huit électrons dans la couche de valence., obéissant à la règle de l'octet, à l'exception de l'hélium gazeux, qui n'a que deux électrons.

Exceptions à la théorie de l'octet
Certains composés parviennent à se stabiliser avec plus ou moins de huit électrons dans la couche de valence. Dans ces cas, des exceptions à la théorie de l'octet se produisent.
expansion d'octet
Cela se produit principalement avec le phosphore (P) et le soufre (S), qui sont des atomes relativement gros et ont le sous-niveau « d ». Dans ce cas, l'atome détient plus de huit électrons dans sa dernière couche.
Exemple:
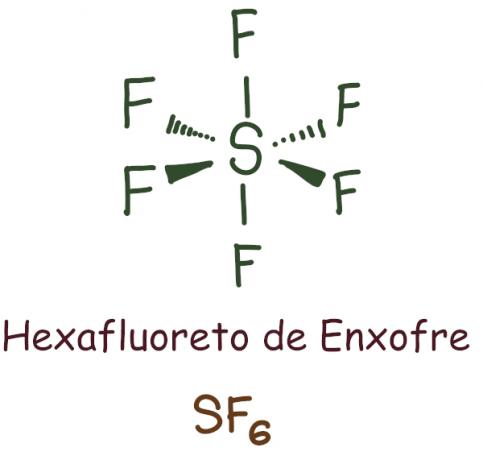
Dans le cas de l'hexafluorure de soufre, l'élément central a été laissé avec 12 électrons, dépassant les 8 requis pour se stabiliser selon la règle de l'octet. Dans ce cas, il y a eu une expansion de l'octet.
contraction d'octet
Se produit avec le béryllium (Be), le bore (B) et certains oxydes d'azote. Voir l'exemple :
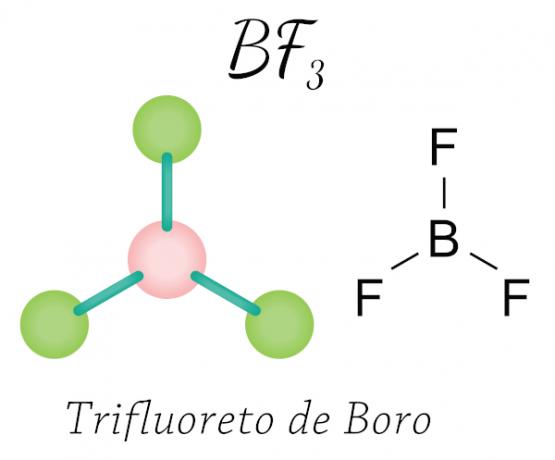
Dans le cas du trifluorure de bore, les atomes de fluor acquièrent les huit électrons nécessaires dans la couche de valence en partageant électronique au bore, respectant la règle de l'octet, mais l'atome central (bore) ne se stabilise pas avec six électrons, se produisant ainsi une contraction de l'octet.
Accédez également à: Classification d'un lien sigma: quels sont les critères ?
exercices résolus
question 1 - (Mackenzie-SP) Pour que les atomes de soufre et de potassium acquièrent une configuration électronique égale à celle d'un gaz rare, il faut que :
(Données: numéro atomique S = 16; K = 19.)
A) le soufre reçoit 2 électrons et le potassium reçoit 7 électrons.
B) le soufre donne 6 électrons et le potassium reçoit 7 électrons.
C) le soufre donne 2 électrons et le potassium 1 électron.
D) le soufre reçoit 6 électrons et le potassium cède 1 électron.
E) le soufre reçoit 2 électrons et le potassium cède 1 électron.
Résolution
Alternative E. Le soufre est un élément de la colonne 16 ou de la famille 6A. Les éléments de cette famille ont tendance à recevoir deux électrons pour former des paires électroniques et ont un total de huit électrons dans la couche de valence. Les éléments de la famille 1A, qui sont les métaux alcalins, n'ont qu'un seul électron dans la couche de valence. En faisant don de cet électron, la couche précédente devient la couche de valence, déjà avec les huit électrons, comme dicté par la règle de l'octet.
Question 2 - Jugez les affirmations suivantes comme vraies (V) ou fausses (F).
I ( ) La règle de l'octet stipule que huit électrons sont nécessaires dans la couche de valence pour que l'atome soit stable.
II ( ) La couche de valence est la deuxième couche électronique de l'atome.
III ( ) Le chlore (Cl), de la famille des halogènes, a tendance à gagner deux électrons pour acquérir de la stabilité.
IV ( ) Le sodium (Na), élément de la famille 1A, a tendance à perdre le seul électron de sa couche de valence.
Marquez la bonne alternative :
A) I, III et IV sont vrais.
B) I et IV sont vrais.
C) Seul II est vrai.
D) Seul le IV est faux.
E) Tout est vrai.
Résolution
Variante B. I et IV sont vrais. L'énoncé II est incorrect, car la couche de valence est la dernière couche électronique de l'atome, pas la seconde. Et l'énoncé III dit que le chlore a tendance à gagner deux électrons, ce qui ne vérifie pas, puisque le chlore, étant de famille 7A ou 17, tend à ne gagner qu'un électron pour acquérir ainsi la configuration électronique d'un gaz noble.
Par Laysa Bernardes Marques de Araújo
Professeur de chimie

