Lorsque nous cuisinons des aliments dans nos maisons, nous utilisons la combustion des gaz de cuisson. Une des choses que l'on peut voir dans la flamme résultant de la combustion de ce gaz est que sa couleur est normalement d'un bleu très clair. Cependant, dans la plupart des réactions de combustion, comme la combustion d'une bougie, la flamme est jaune.

Alors la question se pose :
« Si chaque feu est le résultat d'une réaction de combustion, pourquoi certaines flammes ont-elles des couleurs différentes ?
Pour comprendre comment cela se produit, nous devons comprendre ce qu'est une réaction de combustion et quelles substances sont présentes dans chacune des réactions mentionnées.
Une réaction de combustion se produit lorsqu'un combustible (matière oxydable) est consommé par un comburant (matière gazeuse contenant de l'oxygène) pour générer de l'énergie thermique (chaleur).
Un autre point important que nous devons savoir sur les réactions de combustion est qu'elles peuvent avoir lieu dans un
complet ou incomplet. S'il y a suffisamment d'oxygène pour consommer le carburant, la réaction sera complète et produira du dioxyde de carbone (CO2) et de l'eau (H2O). Sinon, la combustion sera partielle, incomplète, générant du monoxyde de carbone (CO) et de l'eau; ou du carbone (C) et de l'eau.Dans les deux cas que nous analysons, le comburant est l'oxygène présent dans l'air. Cependant, les carburants sont différents. Le gaz de cuisine est en fait du gaz de pétrole liquéfié (GPL), qui est un mélange d'hydrocarbures (alcanes), le principal combustible étant le butane (C4H10). Ainsi, le gaz de cuisson est composé de molécules d'alcanes qui n'ont que trois ou quatre atomes de carbone, c'est pourquoi il faut peu d'oxygène pour que sa combustion se fasse complètement. Cette réaction peut être exprimée comme suit :
1C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 heures2O(g), H < 0
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Dans le cas des bougies, la paraffine est le combustible de la réaction, et elle est constituée d'un mélange d'alcanes avec des atomes de carbone qui allant de 20 à 36. Ainsi, il faut beaucoup plus d'oxygène pour que cette réaction se produise pleinement. Voir un exemple :
1C24H50(s) + 70/2 O2(g) → 25 CO2(g) + 25 heures2O(g), H < 0
Dans l'air, il n'y a pas assez d'oxygène pour effectuer cette combustion complète, elle se déroule donc de manière incomplète, comme indiqué ci-dessous :
1C24H50(s) +49/2 O2(g) → 24 CO(g) + 25 heures2O(g), H < 0
1C24H50(s) +25/2 O2(g) → 24C(s) + 25 heures2O(g), H < 0
Les réactions incomplètes produisent moins d'énergie qu'une combustion complète. Ceci explique la différence entre les couleurs des flammes, car la flamme jaune, caractéristique d'une combustion incomplète, a une énergie plus faible. La flamme bleue est caractéristique d'une combustion complète, avec une plus grande énergie.
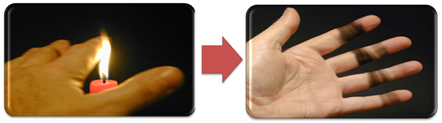
Cela explique également la formation de suie par la flamme de la bougie (photo ci-dessous), qui est du carbone considéré comme le produit d'une combustion incomplète.
Mais pourquoi, dans le bec Bunsen, est-il possible d'avoir des flammes jaunes et bleues alors que le combustible ne change pas ?
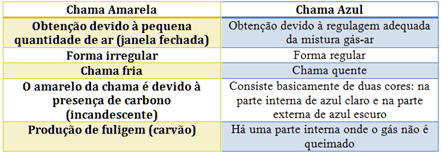
Dans le cas du bec Bunsen, cela est obtenu en régulant l'entrée de gaz et d'air. Si la fenêtre est fermée, provoquant l'entrée d'une petite quantité d'air, la flamme obtenue sera jaune, car elle aura peu d'oxygène pour effectuer une combustion complète. Si la régulation du mélange gaz-air est adéquate, on obtient une flamme bleue.
Voir les caractéristiques de chacun dans le tableau ci-dessous :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Combustion et flammes de différentes couleurs »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm. Consulté le 28 juin 2021.