Gaz et Vapeur
La différence entre le gaz et la vapeur est donnée à partir de la température critique. La vapeur est une matière à l'état gazeux, un état qui peut être liquéfié avec une pression croissante. Le gaz n'est pas le même. C'est un fluide qui ne peut pas être liquéfié par une simple augmentation de pression. Cela rend le gaz différent de la vapeur.
Comportement des gaz
Une substance donnée à l'état gazeux est un gaz si sa température est supérieure à la température critique, si la température est égale ou inférieure à la température critique, la substance est de la vapeur.
Les vrais gaz que nous connaissons normalement, tels que l'hélium, l'azote et l'oxygène, ont des caractéristiques moléculaires différentes et particulières de chacun. Cependant, si nous les mettons tous à haute température et à basse pression, ils commencent à montrer un comportement très similaire. Dans l'étude des gaz, on adopte un modèle théorique simple, qui en pratique n'existe pas, avec un comportement similaire à celui des gaz réels. Cette approximation est d'autant meilleure que la pression est basse et que la température est élevée. Ce modèle de gaz est appelé
Vers les XVIIe et XIXe siècles, trois scientifiques (Jacques Charles, Louis J. Gay-Lussac et Paul E. Clayperon), après avoir étudié le comportement des gaz, a élaboré des lois régissant le comportement des gaz parfaits, aussi appelés gaz parfaits. Les lois qu'ils déterminent établissent les règles du comportement « extérieur » du gaz parfait, conduisant à il ne compte que les grandeurs physiques qui leur sont associées, qui sont: le volume, la température et pression.
Loi générale des gaz parfaits
L'expression qui détermine la loi générale pour les gaz parfaits peut être vue comme suit :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
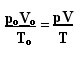
où pO, VO et TO sont respectivement la pression initiale, le volume initial et la température initiale. C'est une expression qui est utilisée lorsque les variables d'un gaz varient.
la loi de Boyle
Robert Boyle, physicien et chimiste, est celui qui a déterminé la loi qui régit les transformations subies par un gaz, lorsque sa température est maintenue constante. Sa loi dit que lorsqu'un gaz subit une transformation isotherme, sa pression est inversement proportionnelle au volume occupé. De cette loi nous obtenons que comment TO = T Nous devons:
POVO = pV
la loi de Charles
La loi de Charles est la loi qui régit les transformations d'un gaz parfait en volume constant. Ces transformations sont appelées transformations isochores ou isométriques. Selon cette loi, lorsqu'une masse de gaz parfait subit une transformation isochore, sa pression est directement proportionnelle à sa température absolue. Mathématiquement, cette loi peut être exprimée comme suit :

où pO et TO sont respectivement la pression initiale et la température initiale.
La loi Gay-Lussac
La loi de Gay-Lussac est la loi qui régit les transformations d'un gaz parfait à pression constante. Cette loi, bien que portant le nom de Gay-Lussac, avait déjà été découverte par le physicien et chimiste A.C. Charles. Selon la loi, lorsqu'un gaz subit une transformation isobare, le volume du gaz est directement proportionnel à sa température absolue. Mathématiquement, cette loi peut être exprimée comme suit :

Où VO et TO correspondent respectivement au volume initial et à la température initiale.
Par Marco Aurélio da Silva
Voir plus !!
Transformations gazeuses
Savoir ce que sont les transformations de gaz.
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SANTOS, Marco Aurélio da Silva. « Étude des gaz »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Consulté le 27 juin 2021.


