La liaison covalente se produit lorsque deux atomes partagent des paires d'électrons afin d'acquérir la configuration électronique d'un gaz noble (avec 8 électrons dans la couche de valence ou avec 2, dans le cas de ceux avec seulement la couche K), selon la règle de octuor.
Cependant, il existe des cas particuliers de liaisons covalentes dans lesquelles la paire d'électrons partagée ne provient que d'un des atomes déjà stable. Auparavant, ce type de liaison covalente était appelé datif, aujourd'hui il est plus communément appelé coordonner.
Voir quelques exemples pour comprendre comment cela se produit :
- CO (monoxyde de carbone) :
Le carbone a 4 électrons dans sa couche de valence. Par conséquent, selon la règle de l'octet, pour être stable, il doit recevoir 4 électrons supplémentaires, pour un total de 8. L'oxygène, d'autre part, a 6 électrons dans la couche de valence et doit recevoir 2 électrons pour obtenir la configuration du néon de gaz noble.
Ainsi, tout d'abord, le carbone et l'oxygène partagent deux paires d'électrons afin que l'oxygène soit stable :
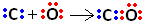
Cependant, le carbone reste instable car il possède encore 6 électrons et en a besoin de 2. Par conséquent, l'oxygène, qui est déjà stable, partage l'une de ses paires d'électrons avec le carbone, c'est-à-dire qu'il établit une liaison dative avec lui, le rendant stable :

Notez que la liaison covalente coordonnée peut être représentée par un tiret, tout comme la liaison covalente commune.
- SEUL2 (Le dioxyde de soufre):
Chaque atome de soufre et d'oxygène a 6 électrons dans leurs couches de valence, ils doivent donc recevoir 2 électrons chacun. Initialement, le soufre crée deux liaisons covalentes communes, partageant deux paires d'électrons avec l'un des atomes d'oxygène, les deux restant stables avec 8 électrons.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Mais, l'autre atome d'oxygène n'est pas stable, donc le soufre partage une paire de ses électrons avec lui via une liaison covalente coordonnée ou dative :
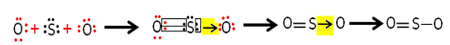
Notez que dans ce cas nous avons trois atomes dans la molécule, il peut donc y avoir une migration de la liaison d'un atome à un autre. La molécule de dioxyde de soufre peut également être représentée comme ceci: O ─ S ═ O.
Nous appelons ce phénomène de liaison résonance. Voir trois autres exemples dans le tableau ci-dessous :
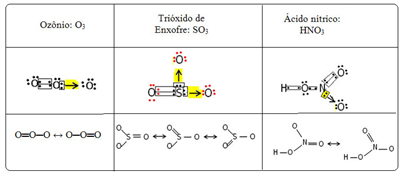
Les structures possibles sont appelées structures de résonance ou alors formes canoniques.
Ce type de liaison se produit également dans la formation d'ions, comme dans le cas des ions hydronium (H3O+) et l'ammonium (NH4+).
Premièrement, le cation H+ il se forme lorsque l'hydrogène perd son seul électron, le laissant avec une charge positive. Il devra donc recevoir deux électrons pour être stable. Cela se produit par une liaison dative avec l'eau (dans le cas de l'ion hydronium) et avec l'ammoniac (dans le cas de l'ion ammonium). Regarder:

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Liaison covalente dative ou coordonnée »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Consulté le 28 juin 2021.

