O calculs de masse atomique d'un élément est la ressource mathématique utilisée pour déterminer la valeur de masse présente dans le tableau périodique de chacun des éléments chimiques existants. En général, pour effectuer les calcul de la masse atomique, nous devons connaître les variables suivantes du élément chimique:
Isotopes des éléments ;
Nombre de masse de chaque isotope de l'élément ;
Pourcentage de chaque isotope de l'élément dans la nature.
Le calcul de la masse atomique de l'hydrogène, par exemple, a été effectué sur la base des données suivantes :
Présente les isotopes du protium (H1), deutérium (H2) et le tritium (H3);
Les masses de ces isotopes sont respectivement 1, 2 et 3 ;
Le pourcentage de Protium dans la nature est de 98,9% ;
Le pourcentage de Deutérium dans la nature est de 0,09 % ;
Le pourcentage de tritium dans la nature est de 0,01 %.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Norme mathématique pour le calcul de la masse atomique
Pour effectuer le calcul de la masse atomique de tout élément chimique, nous devons utiliser le modèle mathématique suivant :
1O: multiplier le nombre de masse de chaque isotope par son pourcentage ;
2O: additionner tous les résultats trouvés dans les multiplications de la première étape ;
3O: divisez la somme trouvée par 100.
MA = nombre de masse.pourcentage + nombre de masse.pourcentage
100
Carte mentale: masse atomique
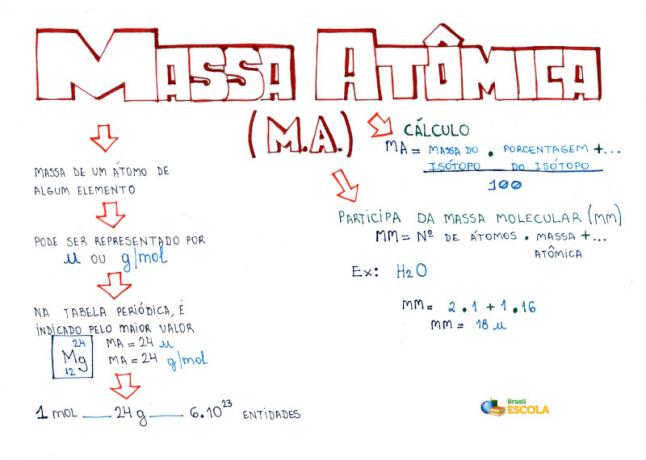
*Pour télécharger la carte mentale en PDF, Cliquez ici!
Exemples de calcul de masse atomique
1er exemple: Calcul de la masse atomique du Soufre.
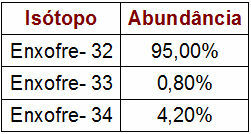
Données de pourcentage et de masse des isotopes du soufre
Le tableau fourni indique le nombre de masse et le pourcentage de chaque isotope du soufre dans la nature. Pour effectuer le calcul de la masse atomique, effectuez simplement les étapes suivantes :
1O Marcher: multiplier le nombre de masse de chaque isotope par la valeur de son abondance.
Soufre - 32 (S32)
s32 = 32.95
s32 = 3040
Soufre - 33 (S33)
s33 = 33.0,8
s33 = 26,4
Soufre - 34 (S34)
s34 = 34.4,2
s34 = 142,8
2O Marcher: additionner les valeurs trouvées dans les multiplications du nombre de masse et de l'abondance de l'isotope.
Somme = S32 + S33 + S34
Somme = 3040 + 26,4 + 142,8
Somme = 329,2
3O Marcher: calculer la masse atomique en divisant la somme des résultats trouvés par 100 :
MA = Somme
100
MA = 3209,2
100
M.A. = 32,092 u
2ème exemple: Un élément chimique (D) donné possède trois isotopes, dont les nombres de masse sont :
30ré 32ré 34ré
Sachant que la masse atomique de cet élément est de 32,20 u et qu'il y a 20% de l'isotope 32D dans la nature, quelle est la valeur des pourcentages des autres isotopes ?
L'énoncé donne les nombres de masse, la masse atomique et le pourcentage d'un des isotopes. Pour déterminer les pourcentages d'autres isotopes, nous devons effectuer les étapes suivantes :
1O Marcher: déterminer le pourcentage de chaque isotope.
Isotope - 30 (DS30)
DS30 = 30.x
DS30 = 30x
Isotope - 32 (DS32)
DS32 = 32.20
DS32 = 640
Isotope - 34 (D34)
DS34 = 34.y
DS34 = 34 ans
2O Marcher: utiliser toutes les données trouvées dans l'expression mathématique pour calculer la masse atomique.
MA = nombre de masse.pourcentage + nombre de masse.pourcentage
100
32,2 = 30x + 640 + 34 ans
100
32,2.100 = 30x + 640 + 34 ans
100
3220 - 640 = 30x+34y
30x + 34y = 2580
x = 2580 - 34 ans
30
3O Marcher: utilisez l'expression trouvée ci-dessus à partir du raisonnement suivant :
Pourcentage d'isotope 1 + Pourcentage d'isotope 2 + Pourcentage d'isotope 3 = 100 %
x + 20 + y = 100
x + y = 100 – 20
x + y = 80
x = 80 - y
2580 - 34 ans = 80 ans
30
2580 – 34 ans = 30. (80 ans)
2580- 34 ans = 2400 - 30 ans
2580 – 2400 = 34a-30a
4 ans = 180
y = 80
4
y = 45%
4O Marcher: calculer la valeur en pourcentage de x dans l'expression construite à la troisième étape.
x + y = 80
x + 45 = 80
x = 80 - 45
x = 35%
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Calcul de la masse atomique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/calculo-massa-atomica.htm. Consulté le 27 juin 2021.